
Детективный роман: попытка преодолеть отторжение трансплантатов
Как мы уже говорили, главная сложность при пересадке органов заключается в том, что организм реципиента отторгает орган донора.
Обычно отторжение трансплантата происходит в несколько этапов. Самая большая опасность подстерегает больного сразу же после операции, затем наступает временное затишье, но через несколько месяцев иммунная система может перейти в активное наступление на пересаженный орган. Первая атака обычно происходит в первые послеоперационные дни в самое опасное время, когда больной еще не оправился от операционной травмы и от последствий болезни, которая вызвала необходимость пересадки. Если больному удается выжить после первого приступа, он может выписаться из больницы и жить относительно нормальной жизнью до второго приступа. Рано или поздно пересаженный орган вновь подверг гнется массированной атаке со стороны иммунной системы и, возможно, перестанет функционировать. В результате больной, ослабленный потерей жизненно важных функций пересаженного органа, скорее всего погибнет.
Таков естественный ход послеоперационных событий в тех случаях, когда не делается попыток предотвратить отторжение. Но уже с первых экспериментов по пересадке органов ученые и хирурги поняли, что для успешного проведения операции необходимо каким-то образом подавить реакцию иммунной системы. Чтобы понять, как они решили эту проблему, необходимо познакомиться с работой иммунной системы.
Иммунная система - это группа органов и клеток, предназначенных для борьбы с болезнетворными бактериями, вирусами, раковыми опухолями, а также для отторжения чужеродных тканей, в том числе трансплантированных. Главный механизм иммунной системы заключается в способности распознавания чужеродных белков. Белки представляют собой длинные, свернутые цепочки аминокислот (рис. 2), которые служат основным строительным материалом нашего организма; белки управляют большинством химических реакций внутри клетки. Тело человека - кожа, волосы, мышцы, ногти, внутренние органы - в основном состоит из белков. Инструкции, или "матрицы", по которым клетки синтезируют все эти разнородные белки, необходимые для нормального роста и возобновления клеток, хранятся в ядре каждой клетки. Информационные матрицы представляют собой цепи молекул ДНК (дезоксирибонуклеиновой кислоты, см. рис. 3). Заложенная в молекуле ДНК и унаследованная нами от родителей информация диктует, какого рода белки будут синтезированы нашими клетками.

Рис. 2. Модель типичного белка. Длинная цепочка аминокислот свернута в хитроумный клубок, что позволяет белку выполнять свои функции в клетке
Большинство белков, закодированных в ДНК, у всех людей одинаковы; особенно это касается белков, участвующих в основных процессах жизнедеятельности. Таков, например, гемоглобин, содержащийся в красных клетках крови (эритроцитах) и переносящий кислород ко всем клеткам нашего тела. Другие белки строго индивидуальны но своей структуре, так что биохимик, подвергая их анализу, может с такой же точностью отличить людей друг от друга, как детектив делает это по отпечаткам пальцев. Только у идентичных (однояйцевых) близнецов все белки полностью совпадают, так как они получили одну и ту же ДНК. Именно поэтому однояйцевые близнецы, похожие друг на друга как две капли воды (о разнояйцевых этого не скажешь), могут без всяких осложнений прибегать к пересадке органов друг от друга, тогда как всем прочим людям прихоходится преодолевать более или менее серьезные трудности, в зависимости от того, насколько их ткани совместимы с тканями донора.
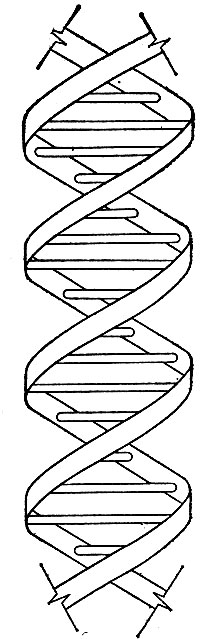
Рис. 3. Структура ДНК, получившая название 'двойной спирали'. Молекула состоит из двух цепочек, каждая из которых сложена миллиардами точнейшим образом расположенных атомов и содержит закодированную генетическую информацию отдельной клетки человеческого организма. Код определяет, какая образуется клетка: к примеру, печени, щитовидной железы или крови
Как же иммунная система узнаёт белки? Нашц уникальные белки находятся на мембранах каждой из миллиардов клеток нашего тела. Мембрана окружает каждую клетку, как кожа, и регулирует усвоение питательных веществ и других химических веществ клеткой, а также выведение продуктов ее жизнедеятельности. Эти белки (получившие название трансплантационных, так как они играют важную роль при трансплантации) действуют наподобие ключей, которые могут подходить к замкам двоякого рода в иммунной системе - клетках типа Т и В. (Т - от названия "тимус", небольшой железы внутренней секреции, находящейся под грудной костью и продуцирующей клетки типа Т; В - от названия "сумка (bursa) Фабрициуса", органа, находящегося в кишечнике у цыплят.) Клетки типа Т и В могут быть "открыты" только индивидуальным ключом для данного человека - его уникальными поверхностными белками.
Когда в тело вторгаются бактерии или вирусы (а также трансплантаты, которые тоже состоят из чужеродных белков), их "ключи" не подходят к замкам типа Т и В. Это несоответствие провоцирует защитную реакцию клеток Т и В. Клетки типа Т становятся истребительными, они нападают на чужие клетки и уничтожают их. Клетки типа В выделяют антитела - белки особого рода, которые "метят" чужаков и привлекают специальные клетки иммунной системы (называемые макрофагами или "пожирателями-великанами"), действительно пожирающие всех чужаков. Сам по себе процесс "мечения" может ослабить мембрану клетки противника, так что она лопается. Иммунная система защищала нас миллионы лет, и отключить ее не так-то просто - даже ради жизненно необходимой операции по пересадке органов.
Случается, что клетки Т и В вдруг, как бы сбившись с толку, начинают нападать на клетки собственного организма, словно они отмечены чужеродным белком. Такая неспособность различать "свое" и "чужое" получила название аутоиммунной болезни: организм нападает на самого себя. Примером могут служить артрит и миастения (дегенерация мышечных нервов). Знаменитый австралийский ученый-медик сэр Фрэнк Макферлан Бёрнет сравнивает аутоиммунную болезнь с "бунтом войск внутренней безопасности в стране". Порой происходит обратное явление: иммунная система отказывается нападать на интервентов. Такая потеря защитной реакции называется толерантностью: иммунная система "терпит" присутствие посторонних организмов.
В норме, по мнению Бёрнета, иммунная система в период внутриутробного развития человека "учится" терпеть только клетки собственного организма и нападать на все прочие. Но до того, как начался этот процесс "обучения", иммунная система человека будет "терпеть" любой белок. Таким образом, аутоиммунная болезнь возникает, когда иммунные клетки "разучиваются" отличать "свое" от "чужого", как бы забывая то, чему научились в период внутриутробного развития. Теория Бёрнета получила экспериментальное подтверждение в опытах сэра Питера Медавара, проведенных в Лондонском университетском колледже в 1953 г. Вскрывая беременных мышей, Медавар аккуратно вводил каждому из зародышей клетки от взрослых мышей. Когда мышата рождались, оказывалось, что они не отторгают кожные трансплантаты, пересаженные рт мышей, чьи клетки
им вводились ранее. Мыши, которым делались прививки во внутриутробном периоде, оказались толерантными к чужим клеткам, потому что эти клетки присутствовали в их организме в то время, когда происходило "обучение" иммунной системы, и эта си"стема приняла введенные клетки за клетки собственного тела. Медавар назвал эту экспериментальную толерантность "приобретенной".
Эксперименты Медавара открыли широкие возможности в будущем. По словам Бёрнета, "как только было доказано, что можно добиться приживления лоскута кожи у мыши... всем стало очевидно, что ту же идею можно использовать при пересадке тканей или органов от человека к человеку". Но одновременно с разработкой этой идеи ученые изыскивали различные пути, пытаясь как можно скорее найти способ борьбы с отторжением трансплантатов.
Убийство рентгеновскими лучами
В 50-е годы единственным способом иммунодепрессии - так медики называют предотвращение реакции отторжения - было разрушение клеток типа В и Т путем облучения всего организма рентгеновскими лучами. Этот метод позволял трансплантату сохраняться более длительное время.
Однако так как главная задача иммунной системы - защищать наш организм от заражения вирусами и бактериями, то, к несчастью, разрушение клеток Т и В устраняло всякую устойчивость к заражению болезнями. Поэтому, когда д-р Джон П. Меррилл, коллега Дэвида Хьюма по больнице Брайама в Бостоне, в апреле 1958 г. столкнулся с тяжелым случаем - у женщины не было обеих почек (и не было однояйцевого близнеца), - он был вынужден впервые прибегнуть к подавлению реакции отторжения путем рентгеновского облучения всего тела. Чтобы предотвратить последующую возможность заражения, женщину поместили на месяц в стерильную операционную. Стерилизации подвергалось все, что окружало больную, и все, с чем она должна была так или иначе входить в контакт: постельное белье, одежда всех, кто допускался в операционную, сама операционная, аппаратура и непосредственно трансплантат.
Пересадка сама но себе оказалась удачной, и вскоре после операции почка стала выделять нормальную мочу, но все же облучение оказалось слишком сильным, и через 32 дня больная умерла от общего заражения. (Люди, подвергающиеся такому интенсивному облучению, могут пасть жертвой вирусов, бактерий или грибов, с которыми при обычных условиях легко справляется иммунная система организма.) Другие группы хирургов во всем мире, занимающиеся пересадкой тканей и органов, были вынуждены применять облучение всего тела просто потому, что иных методов не существовало. И хотя некоторые операции проходили удачно, больные обычно жили после таких операций не более года. Постепенно ученые стали искать менее опасные методы иммунодепрессии. Самым перспективным из них оказался противораковый препарат под названием меркаптопурин.
Раковая терапия для трансплантатов
Клетки системы иммунитета, странствующие по всему организму, изнашиваются быстрее других клеток и нуждаются в постоянном возобновлении. Это происходит путем деления клеток, при котором одна клетка делится на две. А так как воспроизводство (деление) иммунных клеток протекает очень быстро, то они особо чувствительны к препаратам, которые разрушают именно делящиеся клетки. Клетки раковой опухоли также делятся очень быстро, и одно из основных направлений терапии рака было посвящено поиску лекарств типа меркаптопурина, которые были бы способны убить быстро делящиеся клетки.
Опыты на животных показали, что рентгеновское облучение не только убивает Т- и В-клетки, но и разрушает ткани, где они воспроизводятся, тогда как противораковые препараты уничтожают только Т- и В-клетки. Дэвид Хьюм, теперь уже в Медицинском колледже штата Виргиния, экспериментально доказал, что меркаптопурин позволяет продлить жизнь пересаженных почек у собак в шесть раз по сравнению с животными, не получавшими это лекарство. Но применение препарата осложнялось побочными явлениями и возможностью инфекции. В 1960 г. ученые научились частично снимать эти осложнения, пользуясь препаратом, по действию близким к меркаптопурину, но менее токсичным - имураном (или азатиоприном).
Оба лекарства очень быстро были введены в практику и экспериментально использовались во время пересадок почек у людей: меркаптопурин в апреле 1960 г., а имуран - в марте 1961 г. в бостонской больнице Брайама. И хотя оба эксперимента оказались неудачными из-за того, что врачи еще не умели правильно применять лекарства, молодой человек, прооперированный в той же больнице д-ром Джозефом Мурреем в апреле 1962 г., прожил с новой почкой 21 месяц. Более того, за это время он справился с воспалением легких и перенес операцию аппендицита, и большую часть времени жил дома и работал. Когда ночка стала отказывать, ему пересадили новую. В трансплантации наступила новая эра.
Подавление стероидами
Хотя имуран остается столпом иммунодепрессивного воздействия, подобный же эффект оказывают и вещества, называемые кортикостероидами (или, сот кращенно, стероидами). Это синтетические аналоги стероидных гормонов, выделяемых корой надпочечников. Кортикостероиды регулируют множество важнейших функций организма, в частности водно-солевой баланс в тканях. Люди, принимающие стероидды, часто приобретают характерный вид: их лица округляются, как полная луна, от избытка воды в тканях.
Обычно стероиды применяются как дополнение к имурану, когда начинается реакция отторжения, Комбинация имурана со стеродами весьма эффекттивно подавляет реакцию отторжения. Некоторые люди, получившие пересаженную почку не от родственников, живут с новой почкой свыше 10 лет - иными словами, по сравнению с началом 50-х годов жизнь трансплантата продлилась на 1200 %.
Однако имуран и стероиды опасны тем, что они снижают иммунитет организма в борьбе с болезнями, в результате реципиенты подвержены большей опасности заболеть раком, чем средний человек. Считается, что раковые клетки время от времени образуются у всех людей, но болезнь у них не развивается, так как иммунная система разрушает злокачественные клетки, едва они появляются. Поэтому разрушение иммунной системы или ее целенаправленное подавление может привести к тому, что раковые клетки начнут безудержно размножаться и возникнет опухоль.
АЛС для всех
Еще один способ подавления реакции отторжения - введение вещества, называемого АЛС (антилимфоцитарная сыворотка). В отличие от рентгеновского облучения АЛС не разрушает ткани, где образуются Т- и В-клетки, а рассчитана на то, чтобы временно вывести эти клетки из строя.
В 1963 г. сэр Майкл Вудрафф, профессор хирургии Эдинбургского университета, сделал следующее открытие: если ввести Т- и В-клетки крыс кроликам, то в теле кроликов в ответ на вторжение чужеродных белков быстро формируются специфические антитела, разрушающие клетки крыс. Вудрафф взял кровь, содержащую убивающие клетки крысы антитела (называемые АЛС), и перелил ее обратно крысам. После этого крысам были пересажены лоскуты чужой кожи. Как оказалось, АЛС значительно подавляет реакцию отторжения у крыс, убивая специфические клетки Т и В, причем пересаженная кожа остается на месте в 12 раз дольше, чем у крыс, не получивших АЛС.
В 1967 г. после экспериментов на животных д-р Томас Старзл из Чикагского университета испытал АЛС при пересадке почек у человека. В результате больные жили дольше и более редкие попытки отторжения трансплантатов у них проходили легче, чем у тех, кто получал обычные иммунодепрессанты. Другие врачи попробовали применить АЛС на больных, которые перенесли пересадку печени или сердца, и получили обнадеживающие результаты, особенно в тех случаях, когда АЛС применялась в сочетании с имураном и стероидами, а не вместо них.
И все же АЛС обладает по меньшей мере двумя серьезными недостатками. Во-первых, производство АЛС постоянной эффективности сопряжено с многими трудностями, а во-вторых, АЛС способствует, большей вероятности заболевания раком. Не удивительно, что ученые продолжают поиски иных способов помешать отторжению трансплантатов. Одно из таких направлений - десенсибилизация.
Десенсибилизация
Десенсибилизация как результат продолжения более ранней работы Медавара по приобретенной толерантности - процесс, частично заимствованный из методики лечения аллергии. Аллергические реакции сходны с реакциями отторжения тканей. Чужеродный белок, содержащийся, например, в волоске кошки или пыльце растений, провоцирует слабую реакцию отторжения в чувствительной слизистой оболочке глаз, носа и горла, вызывая насморк, слезотечение и раздражение оболочки этих органов.
Многие виды аллергии лечат инъекциями ничтожных количеств белка-аллергена. Иногда после нескольких сеансов организм десенсибилизируется: небольшие количества белка уже не вызывают аллергической повышенной реакции, хотя до сих пор никто не знает, в чем секрет такой десенсибилизации.
Со времени ранних работ Медавара было известно, что если ввести чужеродные белки зародышу, то позднее, после рождения, он примет пересаженный лоскут кожи, скажем, от донора введенного белка. Но все считали, что человека, когда он уже родился, невозможно десенсибилизировать к чужеродным белкам, по крайней мере к тем, которые несут клетки пересаженного органа.
А вот у животных можно было добиться десенсибилизации. Чужеродные белки, полученные от коров (очищенная сыворотка), в ничтожных количествах вводили взрослым кроликам. Вначале кролики реагировали на чужеродной белок, но после двенадцатидневных повторных инъекций реакция постепенно угасала; кролики были слегка десенсибилизированы.
Исследователи испытывали различные схемы введения чужеродного белка и различные методы изменения его состава, пытаясь добиться большей эффективности в преодолении реакции иммунной системы, но до сих пор для людей десенсибилизация остается только мечтой. Предстоит решить две задачи. Во-первых, чтобы добиться десенсибилизации у животных, нужно подвергать их воздействию чужеродных белков длительное время. Но при пересадке у человека такой возможности нет, так как орган умершего должен быть использован немедленно. Во-вторых, в экспериментах с животными использовались только очень чистые типы белков. Между тем при пересадке органа хирурги помешают в тело человека сотни типов разнообразных белков, и десенсибилизировать его к такому множеству белков трудно. И все же десенсибилизация позволяет надеяться на возможность подавления реакции отторжения у людей, не разрушая защитную иммунную систему в целом.
Поиски подходящего донора
Два способа дают возможность несколько уменьшить необходимость подавления иммунитета - они позволяют врачам заранее предсказать интенсивность реакции отторжения у данного больного. Один из них, способ смешивания лимфоцитов, заключается в проверке реакции иммунных клеток реципиента на клетки будущего донора. К сожалению, для окончательного ответа требуется около семи дней, а при пересадке органов для спасения жизни больного такие сроки слишком велики.
Второй способ состоит в "типировании" клеток донора и реципиента примерно так же, как это делается для определения групп крови перед переливанием. В этом случае результаты становятся известными очень быстро - в течение часа. Однако применение этого способа тоже ограничено: тестирующие растворы для всех видов "типирования" не всегда находятся под рукой, так что полностью определить тип всех клеток невозможно. К тому же можно упустить какую-нибудь причину несоответствия, которая вызовет реакцию отторжения и в конечном счете приведет к разрушению пересаженного органа.
И все же тесты на совместимость - близкое соответствие трансплантационных белков - позволили хирургам достигнуть больших по сравнению с прежними успехов в трансплантации, так как они позволяют уменьшить объем иммунодепрессивных процедур. Тем самым опасность, что больной после пересадки подхватит какую-нибудь инфекцию или заболеет раком из-за того, что его иммунитет слишком подавлен, также значительно уменьшается.
|
ПОИСК:
|
© GELIB.RU, 2013-2019
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'