
Синтез коллагена
Внутриклеточные процессы
В опытах по гибридизации соматических клеток с использованием фибробластов человека и мыши установлено, что гены, ответственные за синтез коллагена типа I и III человека, расположены в разных хромосомах [61]. α-Цепь каждого типа кодируется отдельной моноцистронной мРНК. Следовательно, разные α-цепи кодируются разными генами [18]. Изучение гибридизации РНК-ДНК с использованием кДНК, полученной с помощью мРНК для про-α-цепей, показало, что для α-цепи каждого типа есть только один ген [26]. мРНК для про-α-цепи содержит ~4500 нуклеотидов и имеет на 3′-конце полиадениловый "хвост" длиной ~150 нуклеотидов [35]. Предшественник коллагена - проколлаген (про-α) транслируется с мРНК на полирибосоме в шероховатом эндоплазматическом ретикулуме примерно за 4,8 мин. Про-α1 и про-α2 синтезируются на отдельных полирибосомах.
Про-α состоит из ~1500 остатков и имеет мол. массу ~150000. Он имеет NH2- и COOH-концевые участки, NH2-пропептид и COOH-пропептид, к которым присоединены короткие телопептиды в 15-25 остатков (рис. 4.9). Структура этих участков отличается от структуры, свойственной коллагену, и характеризуется отсутствием спиральной конформации.
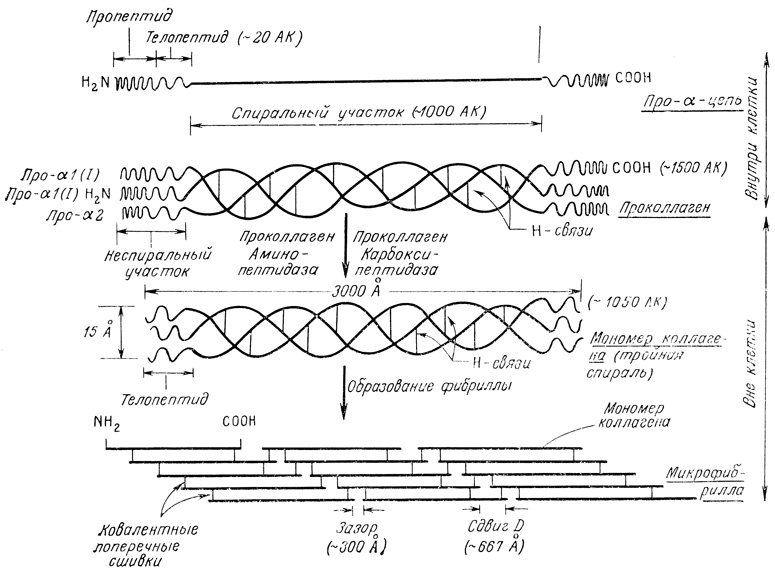
Рис. 4.9. Биосинтез коллагена. Про-α-цепи синтезируются на полирибосомах. Эти цепи имеют концевые неспиральные участки, в которых нет типичной для коллагена последовательности Gly-X-Y. Про-α-цепи объединяются в клетках в тройную спираль проколлагена за счет образования водородных связей, а затем выделяются в межклеточный матрикс. Специфические пептидазы удаляют с обоих концов проколлагена пропептиды, в результате чего образуется мономер коллагена. Лизиновые остатки модифицируются ферментами и образуют ковалентные связи между цепями. Мономеры коллагена объединяются в микрофибриллы. Мономеры удерживаются друг около друга ковалентными поперечными сшивками между модифицированными лизиновыми остатками. АК - аминокислота
Возможно, NH2-пропептид сигнализирует о секреции, как это имеет место в случае других секреторных белков. Некоторые пролиновые и лизинговые остатки в ходе трансляции гидроксилируются. Гидроксилирование происходит даже по окончании трансляции. В NH2- и COOH-пропептидных областях коллагена всех типов присутствуют цистеиновые остатки [34]. Они образуют S - S-связи между цепями и способствуют выстраиванию α-цепей при образовании тройной спирали [60]. Из клетки выходят только правильно построенные тройные спирали. Следовательно, образование S - S-ковалентных связей между цепями помогает не только выстраиванию, но и секреции мономеров [68]. Некоторые гидроксилированные Lys перед формированием тройной спирали гликозилируются [12]. Степень гидроксилирования Pro и Lys и гликозилирования оксилизина (Hyl) соответствует ряду: тип III>тип II>тип I. Время, которое требуется на эти модификации, также подчиняется этому порядку.
Гидроксилирование пролина
Гидроксилирование Pro стабилизирует тройную спираль. Эту реакцию катализирует пролилгидроксилаза [40, 60] - фермент, связанный с шероховатым эндоплазматическим ретикулумом. Фермент, выделенный из куриных эмбрионов, имеет мол. массу 230 000. Он представляет собой тетрамер, состоящий из мономерных субъединиц двух типов - с мол. массой 60000 и 64000 [60]. Мономер неактивен. Молекула фермента имеет сильно выраженные кислотные свойства, ее pI=4,4. Пролингидроксилаза катализирует превращения только пептидилпролина, по отношению к свободному пролину она неактивна. Этот фермент является оксигеназой со смешанными функциями. Для его активирования требуются молекулярный кислород, Fe2+, α-кетоглутаровая и аскорбиновая кислоты. Одновременно с гидроксилированием пролина α-кетоглутаровая кислота окислительно декарбоксилируется с образованием сукцината. При этом выделяется CO2, количество которого измеряют при определении активности фермента. Кислород расходуется в реакции прямого замещения в положении С-4 пролинового остатка. Есть сообщение [52], что аскорбиновая кислота нужна не для самой реакции гидроксилирования, а для последующего восстановления железа в ферменте. Субстраты связываются с ферментом в следующем порядке: Fe2+, α-кетоглутаровая кислота, кислород, полипептид. Гидроксилирование происходит только после того, как все четыре субстрата связались с ферментом. Продукты удаляются в следующем порядке: гидроксилированный пептид, CO2, сукцинат. Аскорбат не расходуется стехиометрически. Он ассоциирует с ферментом либо до связывания железа, либо после удаления одного или двух продуктов [86]. In vitro несколько пролиновых остатков гидроксилируются в отсутствие аскорбата. По-видимому, аскорбат не является необходимым для гидроксилирования [64]. Он требуется для регенерации железа в восстановленной форме. При недостатке аскорбиновой кислоты цепи коллагена гидроксилируются не полностью [8].
Пролиновые остатки гидроксилированы в основном в положении С-4, но в некоторой степени - и в положении С-3. В коллагене типа I и II С-3-гидроксилированный атом встречается только в соотношении 1 на цепь, а в коллагене типа IV-10- 15 на цепь. В реакциях гидроксилирования этих двух видов участвуют два разных фермента [84]. При ингибировании гидроксилирования пролина предотвращается образование тройной спирали мономера и уменьшается ее стабильность. Кроме того, при таком ингибировании коллаген не накапливается в шероховатом эндоплазматическом ретикулуме и не выделяется из клетки. Гидроксилирование происходит до образования тройной спирали, так как было показано, что она не является субстратом в реакции гидроксилирования [10]. Гидроксилирование пролина можно предотвратить включением его аналогов, ограничением количества кислорода и связыванием железа в хелат. В заключение отметим, что гидроксилирование пролина является ключевым фактором в регуляции биосинтеза коллагена и в формировании его структуры.
Гидроксилирование лизинового остатка
Лизин включается в про-α-цепи в ходе трансляции. Его гидроксилирование катализируется лизилгидроксилазой [48]. Фермент, выделенный из куриных эмбрионов, имеет мол. массу 550000 и 200000 [60]. Как и для пролилгидроксилазы, для его активации необходимы молекулярный кислород, α-кетоглутаровая кислота, Fe2+ и аскорбиновая кислота. Обе гидроксилазы имеют близкие значения КМ. Они обратимо ингибируются n-хлормеркурибензоатом (nХМВ), что указывает на участие в катализе SH-групп фермента. Дитиотрейтол увеличивает активность обеих гидроксилаз. Как и гидроксилирование пролина, гидроксилирование лизиновых остатков происходит до образования тройной спирали. Обе гидроксилазы, выделенные из изолированных клеток сухожилия куриных эмбрионов, ингибируются гидрокортизонацетатом [55]. Последний ингибирует также синтез коллагена, причем это ингибирование обратимо. Содержание гидроксилизина (Hyl) различно в коллагене разных типов и с возрастом увеличивается [6]. При недостатке витамина D содержание Hyl в коллагене растет [80].
Если гидроксилирование пролина необходимо для формирования тройной спирали, то гидроксилирование лизина нужно для образования ковалентных поперечных сшивок между цепями, которое происходит вне клетки. Остатки Hyl, кроме того, служат центрами присоединения Сахаров. Недостаток лизилгидроксилазы в организме приводит к нарушениям в структуре соединительных тканей, при которых наблюдаются аномальные механические свойства кожи и связок (синдром Элерса - Данлоса). В ходе развития организма уровень лизилгидроксилазы понижается [7]. Таким образом, она также может быть ключевым фактором в регуляции биосинтеза коллагена и в формировании его структуры.
Гликозилирование проколлагена
Гликозилирование проколлагена - это посттрансляционная модификация про-α-цепей, которая представляет собой ферментативный процесс, протекающий внутриклеточно в шероховатом эндоплазматическом ретикулуме до того, как тройная спираль проколлагена выйдет из клетки. В молекуле коллагена есть галактозилоксилизиновые и глюкозилгалактозилоксилизиновые остатки. Галактозиловая группа связана 0-гликозидной связью с гидроксильной группой Hyl (0-β-D-галактопиранозилоксилизин). Вблизи центра гликозилирования наблюдается характерная последовательность аминокислот: Gly - X - Hyl - Arg [49]. Считают, что эта область может быть носителем главной антигенной детерминанты коллагена. Вносит ли гликозилирование свой вклад в образование сшивок между цепями и (или) в соединение мономеров при формировании фибрилл коллагена, неизвестно.
В реакции гликозилирования принимают участие ферменты галактозилтрансфераза и глюкозилтрансфераза. Они переносят галактозиловый и глюкозиловый остатки UDPгликозида на оксилизин и галактозилоксилизин про-α-цепей в цистернах шероховатого эндоплазматического ретикулума. Кофактором для того и другого фермента служит Mn2+. Глюкозилтрансфераза представляет собой одиночную цепь с мол. массой 70000. Этот фермент высоко специфичен и катализирует только перенос глюкозы на галактозиловый остаток про-α-цепи [1, 2]. Субстратом для обоих ферментов является только одиночная про-α-цепь. Ни тройная спираль мономера проколлагена, ни свободный Hyl не гликозилируются. Кроме того, эта реакция протекает при специфической последовательности аминокислот в цепи Gly - X - Hyl, если X не является Pro или Hyp. Это указывает на то, что гликозилирование происходит до того, как про-α-цепи агрегируют. Следовательно, скорость формирования тройной спирали может определяться скоростью гликозилирования. In vitro гликозилирующий фермент из клеток сухожилия куриного эмбриона ингибируется кортизолацетатом [55].
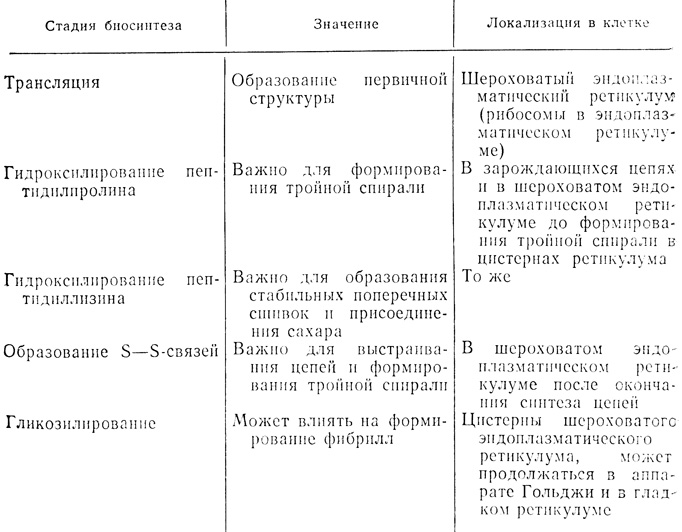
Таблица 4.2. Процессы биосинтеза коллагена
Все четыре фермента, необходимые для внутриклеточной модификации про-α-цепей: пролил- и лизилгидроксилазы и галактозил- и глюкозилтрансферазы, у куриных эмбрионов имеют наибольшую активность в возрасте 14-16 сут [66]. Степень гидроксилирования лизиновых остатков в коллагене типов I и III мала, и, следовательно, в тканях, которые содержат этот коллаген, низок уровень галактозил- и глюкозилтрансферазы. В коллагене типов II и IV, который имеется в связках и в базальных мембранах соответственно, гидроксилирование лизина протекает активно, и уровень гликозилтрансфераз здесь также высок. Степень гликозилирования в коллагене разных тканей различна.
Секреция проколлагена
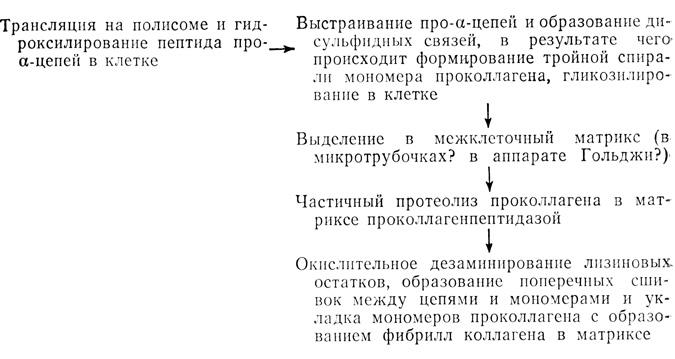
Тройная спираль проколлагена выделяется в межклеточный матрикс. В клетках фибробластов в культуре in vitro при ингибировании образования микротрубочек уменьшается выход проколлагена, а также его превращение в коллаген. Выход проколлагена из фибробластов уменьшается и при ингибировании гидроксилирования пролиновых остатков путем связывания Fe2+ в хелаты или путем инкубации клеток в анаэробных условиях. Добавление в среду инкубации аналогов пролина и лизина приводит к тому же результату. Считают, что скорость синтеза коллагена регулируется гидроксилированием пролиновых остатков, внутриклеточным пулом пролина и уровнем пролилгидроксилазы. Существует также несколько других контрольных пунктов - это трансляция на полисомах, агрегация цепей и их секреция. Нарушение процессов в любом из этих пунктов может замедлить синтез коллагена. Схема его синтеза выглядит следующим образом:
Внеклеточные процессы
Частичный протеолиз
Тройная спираль проколлагена после выхода в межклеточный матрикс подвергается частичному протеолизу и превращается в полностью сформированный мономер коллагена [85]. Две разные проколлагенпептидазы, обе внеклеточные, одна - специфическая для NH2-концевого пропептида, другая - для COOH-концевого пропептида, отщепляют от NH2- и COOH-концов соответственно неспиральные пропептиды [41, 51, 54]. Первым отщепляется NH2-пропептид, затем COOH-пропептид [13]. Пептидазы не являются сериновыми ферментами и не ингибируются SH-реагентами [25]. NH2-пептидазу выделили в чистом виде из кожи, сухожилия и связок крыс и костей кур. Она активна при нейтральном рН и не ингибируется n-хлормеркурибензоатом (nХМБ). Одиночные про-α-цепи также служат субстратом для этого фермента. Он расщепляет пептидные связи между X - Glu и X - Gin. Затем Glu и Gin на NH2-конце циклизуются в остатки пирролидонкарбоновой кислоты. Каждая полностью сформированная цепь в результате содержит ~1012 остатков и имеет мол. массу 95000. Девяносто пять процентов каждой цепи имеют в каждом третьем положении, за исключением небольших участков на NH2- и COOH-концах, глициновый остаток. Об изменениях проколлагенпептидазы с возрастом имеющиеся сведения скудны. Известно, лишь, что при наследственной болезни крупного рогатого скота - дерматозпараксизе (неэластичная кожа, слабые суставные связки), для которой характерна невыраженная бороздчатость коллагена, уровень фермента очень низок.
Модификация оксилизиновых остатков и образование поперечных сшивок
Гидронсилиорование пролиновых и лизиновых остатков происходит в клетке. Оксилизиновые остатки в α-цепях подвергаются дальнейшей химической модификации в межклеточном матриксе. Эти процессы играют важную роль в образовании ковалентных поперечных сшивок полипептидных цепей и формировании коллагеновых фибрилл. Известно, что при нарушениях в ходе модификаций меняется структура, а следовательно, и функции коллагена. О возрастных изменениях в реакциях модификации оксилизиновых остатков известно мало, имеется лишь некоторая информация о нарушениях при ряде заболеваний. При синдроме Элерса - Данлоса, для которого характерны потеря эластичности кожи и связочного аппарата с повторными вывихами суставов, обнаружено заметное уменьшение числа оксилизиновых остатков [59]. Коллаген кожи становится аномально растворимым в денатурирующих агентах, а количество лизилгидроксилазы значительно уменьшается то сравнению с нормой. Возможно, это связано с неправильным образованием поперечных сшивок, когда многие из оксилизиновых остатков становятся недоступными.
В коллагене обнаружены три основных типа поперечных сшивок [74, 76, 77, 79]. Они образуются после ферментативной модификации лизиновых остатков в альдегидную форму, аллизин, вне клетки с помощью фермента лизилоксидазы. Аллизин играет важную роль в возникновении сшивок. Поперечные сшивки можно идентифицировать путем их восстановления боргидридом натрия (NaBH4). Если использовать меченый тритием NaB3H4, тритий включается в поперечные сшивки, которые затем и определяют. Подобные исследования показали, что сшивки представляют собой альдимин (шиффово основание). Структура некоторых из них приведена ниже.
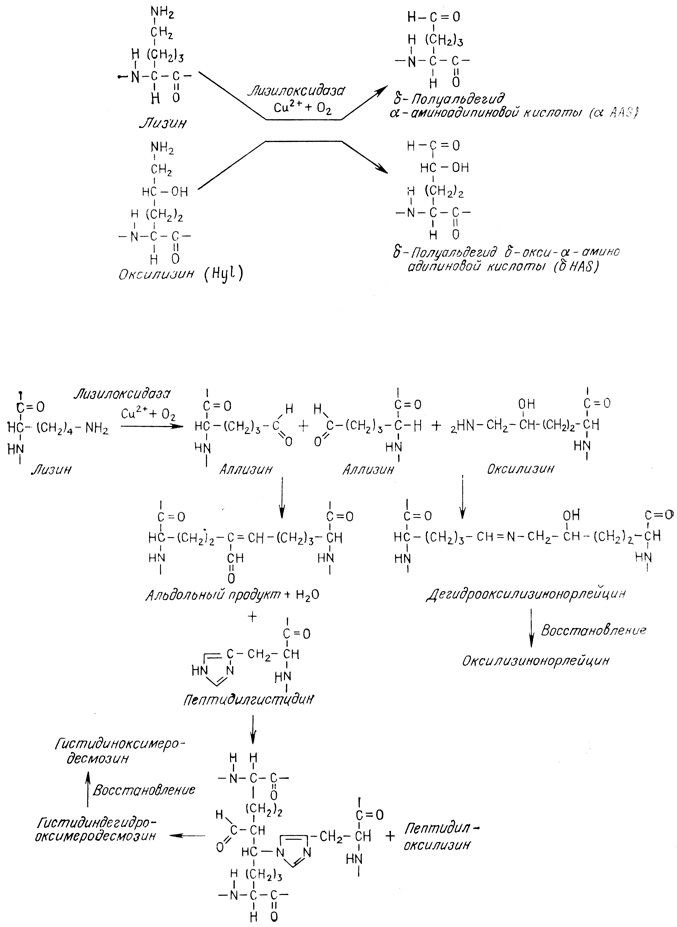
Схема 4.1
Лизилоксидаза - внеклеточный фермент, содержащийся в костях и других тканях, катализирует удаление NH2-групп лизиновых и оксилизиновых остатков в неспиральных NH2- и COOH-концевых участках и одновременно окисляет ε-углерод в CHO. При этом образуются δ-полуальдегид α-аминоадипиновой кислоты (аллизин) и δ-толуальдегид δ-окси-α-аминоадипи-новой кислоты соответственно. Поперечные сшивки образуют только δ-полуальдегид α-аминоадипиновой кислоты и δ-полуальдегид δ-окси-α-аминоадипиновой кислоты [77]. Фермент специфически дезаминирует лизиновые остатки полипептидной цепи, но не активен по отношению к свободному лизину. Он ингибируется β-аминопропионитрилом. В культуре клеток фибробластов in vitro поперечные сшивки в мономерах коллагена не возникают, если в среду добавлен β-аминопропионитрил или в ней недостаточно меди. Описанный дефект аналогичен наблюдаемому при латиризме.
Альдегидные группы легко вводятся в Lys9 α1-цепи и в Lys6 α2-цепи l[83]. Lys1044 в COOH-концевом участке (девятый от COOH-конца) также превращается в аллизин [65]. В COOH-концевом участке есть и оксилизиновые остатки, которые тоже вносят вклад в образование поперечных сшивок. Некоторые из наиболее типичных поперечных сшивок изображены на схеме 4.2.
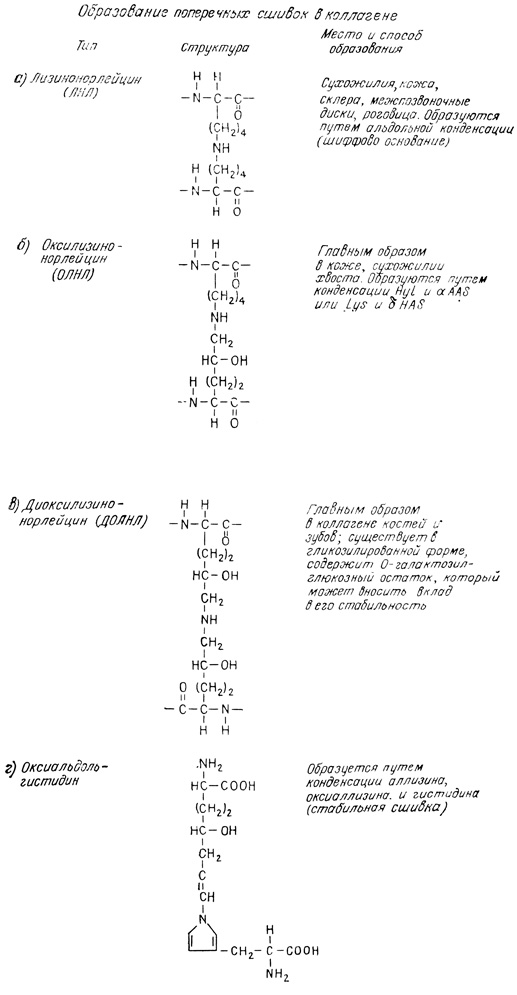
Схема 4.2
Поперечные сшивки коллагена различны в разных тканях и в α-цепях разных типов [3]. Например, в связках, в которых проколлаген образуется только из α1(II)-цепей, поперечные сшивки представляют собой в основном дегидродиоксилизинонорлейцин (ДДОЛНЛ). Такие же сшивки есть в коллагене матки, состоящем из α1- и α2-цепей. Из цепей этих двух типов более предпочтительно сшиваются α2-цепи. Поэтому при фракционировании коллагена из таких тканей получают в основном димеры α2 и мономеры α1. Кроме того, оказалось, что природа поперечных сшивок зависит от степени гидроксилирования лизиновых остатков в NH2-концевом тело пептиде. В тканях типа костей и связок, в которых содержится наименее растворимый коллаген, образуется ДДОЛНЛ. В коллагене сухожилий, кожи и других тканей кроме ДДОЛНЛ имеются другие, более лабильные сшивки типа дегидроксинорлейцина (ДОНЛ), В образование межмолекулярных связей включается и фракция С, но в коллагене костей, связок и матки она практически отсутствует. Обнаружено, что в матке, коже и других мягких тканях она имеет в основном специальные функции.
Предложена модель превращения проколлагена в коллаген [14]. Цистеиновые остатки на COOH-конце про-α-цепи образуют S - S-связи, что способствует выстраиванию цепей в тройную спираль проколлагена в клетке. После секреции во внеклеточное пространство NH2-концевая протеаза удаляет NH2-концевые пропептиды. Затем с помощью COOH-концевой протеазы удаляются COOH-концевые пропептиды, при этом исчезают и участки, связанные S - S-связями, и образуется молекула коллагена. В коллагене нет COOH-концевых участков, связанных S - S-связями.
|
ПОИСК:
|
© GELIB.RU, 2013-2019
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'