
Иммуноглобулины
Основная структура иммуноглобулина включает две короткие, или легкие (L), и две длинные, или тяжелые (Н), цепи. Отсюда молекулярная формула мономера иммуноглобулина L2H2. L-цепь содержит ~216 аминокислотных остатков, и ее мол. масса составляет ~25000. Н-цепь содержит 430 аминокислотных остатков, а ее мол. масса ~50000, т. е. мол. масса Ig ~150000. NH2-конец половины L-цепи, содержащий около 108 остатков, называется вариабельной (V) областью, так как в этой области обнаруживают большинство замен аминокислотных остатков L-цепи различных Ig. Более того, эта область имеет три гипервариабельных (hv) участка, где находится наибольшее число изменений. COOH-конец полуцепи называется константной (С) областью. Каждая L-цепь. ковалентно связана с одной Н-цепью S - S-связью через цистеиновый остаток ее COOH-конца. Известны два типа L-цепей - каппа (χ) и лямбда (λ), которые отличаются друг от друга аминокислотными последовательностями константных областей. Обе L-цепи любого Ig принадлежат к одному типу, χ или λ. L-цепи синтезируются в шероховатом эндоплазматическом ретикулуме на полисомах, состоящих из 6-8 рибосом. Их синтез происходит независимо от синтеза Н-цепей.
Около 108 остатков NH2-конца Н-цепи, что является первой ее четвертью, составляют вариабельную область. В каждой вариабельной области имеются три гипервариабельных участка. Остальные три четверти Н-цепи являются константной областью. Две Н-цепи Ig ковалентно связаны друг с другом S - S-связями в их константных областях. По последовательности константных областей различают пять типов Н-цепей: альфа, (α), дельта (δ), эпсилон (ε), гамма (γ) и мю (μ); они положены в основу классификации иммуноглобулинов, в соответствии с которой последние разделяются на пять классов: IgA, IgD, IgE, IgG, IgM. Иммуноглобулины D, E и G представлены мономерами. Иммуноглобулин А имеет мономеры и димеры (L2H2)2. Иммуноглобулин М содержит только пентамеры (L2H2)5. Димеризации IgA способствуют две экстраполипептидные цепи - связывающая цепь (J) и секреторный компонент (SC). Пентамерная форма IgM существует благодаря наличию J-цепей, которые ковалентно связывают пять мономеров. Иммуноглобулины всех пяти классов имеют углеводные компоненты, прикрепленные к константным областям их Н-цепей.
Иммуноглобулин А подразделяется на два подкласса по типу Н-цепей: α1 и α2. IgG объединяет четыре подкласса, так как имеются 4 типа γ-цепей: γ1, γ2, γ3 и γ4. Каждый класс или подкласс иммуноглобулинов имеет несколько аллельных вариантов, которые являются взаимоисключающими формами и отличаются аминокислотными последовательностями вариабельных, особенно гипервариабельных участков. Этим объясняется способность животного организма продуцировать для борьбы с тысячами антигенов, которые могут встретиться, иммуноглобулины многих тысяч типов.
Строение иммуноглобулина G иллюстрирует рис. 7.6. Рис. 7.7 дает представление о некоторых характеристиках различных иммуноглобулинов. Гипервариабельные области L- и Н-цепей одной половины молекулы Ig участвуют в связывании одной молекулы антигена, т. е. каждый Ig связывает две молекулы одного и того же антигена. Для выяснения роли различных участков молекулы в иммунном ответе был предпринят структурный анализ IgG. После обработки папаином происходит разрыв S - S-связей в NH2-концевых участках двух Н-цепей, в результате чего освобождаются два антигенсвязывающих фрагмента, каждый из которых содержит L-цепь и NH2-концевой участок одной Н-цепи. COOH-концевые участки двух Н-цепей, соединенные S - S-связями, называются кристаллизуемыми фрагментами Fc. Они ответственны за другие биологические функции, такие, как транспорт иммуноглобулинов крови матери эмбриону через мембрану плаценты во время внутриутробного развития и взаимодействие с клеточной мембраной иммунокомпетентной клетки.
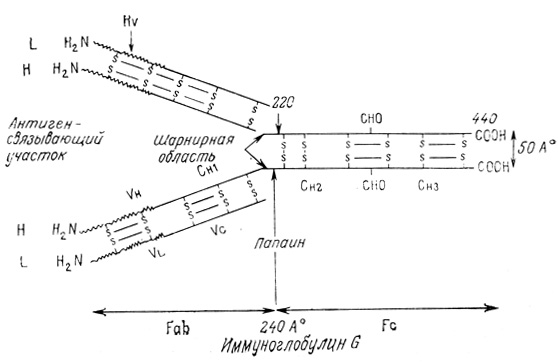
Рис. 7.6. Строение иммуноглобулина G
![Рис. 7.7. Класс иммуноглобулинов определяют по типу тяжелой цепи в молекуле. Имеется 5 классов тяжелых цепей: μ, γ, α, δ и ε; классы γ и α имеют подклассы. Кроме того, каждый иммуноглобулин может иметь любую из двух типов легких цепей - χ или λ. Некоторые Ig образуют олигомеры или комплекс, состоящий из нескольких субъединиц. IgM обычно представляет собой пентамер, содержащий пять субъединиц и добавочную 'соединительную' цепь, или J-цепь. IgA может быть мономером, димером или тримером, состоящим соответственно из 1, 2 и 3 субъединиц. J-цепь представлена олигомерными формами и димером; в слюне и слезах она связана с еще одним полипептидом - секреторным компонентом (SC; от англ. secretory component) [19]](pic/000093.jpg)
Рис. 7.7. Класс иммуноглобулинов определяют по типу тяжелой цепи в молекуле. Имеется 5 классов тяжелых цепей: μ, γ, α, δ и ε; классы γ и α имеют подклассы. Кроме того, каждый иммуноглобулин может иметь любую из двух типов легких цепей - χ или λ. Некоторые Ig образуют олигомеры или комплекс, состоящий из нескольких субъединиц. IgM обычно представляет собой пентамер, содержащий пять субъединиц и добавочную 'соединительную' цепь, или J-цепь. IgA может быть мономером, димером или тримером, состоящим соответственно из 1, 2 и 3 субъединиц. J-цепь представлена олигомерными формами и димером; в слюне и слезах она связана с еще одним полипептидом - секреторным компонентом (SC; от англ. secretory component) [19]
Вариабельность иммуноглобулинов
Каждый клон В-лимфоцитов вырабатывает плазматические клетки, которые синтезируют Ig только одного типа. Вариабельные и константные области L- и Н-цепей Ig кодируются различными генами [10, 23, 75, 93, 119, 128]. Имеются три семейства генов иммуноглобулинов. Полагают, что одно семейство состоит из набора генов, кодирующих вариабельные области как L-, так и Н-цепей. Близко на той же хромосоме расположено второе семейство, состоящее из меньшего числа генов, которые кодируют две константные области L-цепи, χ и λ. Третье семейство кодирует константные области различных классов и подклассов Н-цепей. Гены внутри каждого семейства сцеплены, но сами семейства не сцеплены. Каждое семейство генов Ig представлено в гаплоидном наборе хромосом, полученном от одного родителя, только один раз. Предполагают, что проявляются гены только одной из двух хромосом, поскольку известно, что даже у индивидуума, гетерозиготного по генетическому маркеру Ig, в каждой плазматической клетке выражается только один аллель. Это явление называется аллельным исключением [19].
Каков же механизм, благодаря которому в организме животного вырабатываются тысячи типов различных иммуноглобулинов? Этот механизм должен обеспечить селективную экспрессию только одного из двух генов L-цепи, χ или λ; при этом вариабельный ген должен функционировать вместе с константным. По данному механизму определенный вариабельный ген должен функционировать вместе с одним из пяти константных генов для Н-цепи: α, δ, ε, γ, μ. Неизвестно, сколько имеется вариабельных генов. В соответствии с теорией гаметического наследования в геноме представлена вся совокупность необходимых вариабельных генов, однако для их размещения потребовалось бы очень много места. Сторонники теории соматических мутаций полагают, что многообразие вариабельных генов создается мутационным процессом и потому не наследуется.
В настоящее время считается, что гетерогенность антител (т. е. способность организма вырабатывать разнообразные иммуноглобулины для того, чтобы справиться с любым антигеном), вероятно, зависит от наличия в геноме 4-6 генов для вариабельных областей. Согласно этому взгляду, гетерогенность возникает благодаря сочетанию вариабельных генов с очень небольшим числом генов константной области, а также благодаря перестановкам и комбинациям между L- и Н-цепями. Дальнейшие изменения вариабельных генов могут быть вызваны рекомбинациями и соматическими мутациями [10, 25, 93, 103, 104, 119, 128]. Это возможно благодаря существованию гипермутабельных (hv) областей вариабельных генов, которые могут быть предрасположены к таким мутациям.
Гены вариабельных и константных областей L- и Н-цепей не соседствуют друг с другом [10, 23, 75, 93]. В стволовых клетках эмбриона они разделены большими промежуточными областями. Во время процессинга в костном мозге или в фабрициевой сумке V- и С-гены, очевидно, сближаются путем перестройки ДНК, но остаются разделенными промежуточной последовательностью. Селекция V и С-геное возникает, вероятно, после того, как антиген связывается с В-лимфоцитом. При этом V- и С-гены транскрибируются как единый предшественник гетерогенной ядерной РНК (гяРНК), имеющий нетранслируемую последовательность. Затем гяРНК подвергается в ядре сплайсингу и процессингу, в результате чего появляется зрелая мРНК, которая транслируется с образованием L-цепи, имеющей смежные V- и С-области. Описанная модель иллюстрируется рис. 7.8 и 7.9 [93]. В ней видны черты, сходные с транскрипцией и образованием предшественников мРНК для овальбумина и глобулина, которые также имеют промежуточные нетранслируемые последовательности, или интроны.
![Рис. 7.8. Двухстадийная модель интеграции константной и вариабельной области гена [93]. Стадия 1: перестройка ДНК и коммитирование клеток к V-гену. На этой стадии V- и С-гены ДНК зародышевой клетки разъединены. В антителопродуцирующей клетке эти гены сближаются, но их все-таки разделяет промежуточная нуклеотидная последовательность. Такая перестройка, или транслокация, ДНК представляет собой классическое 'интеграционное' событие, которое позволяет индивидуальной антителообразующей клетке коммитироваться к V-гену. Стадия 2: функциональная интеграция (связывание V- и С-областей в мРНК). На этой стадии в результате транскрипции активированного гена образуется предшественник ядерной РНК, который включает V-, С-области и промежуточную последовательность. Функциональная интеграция V- и С-областей происходит во время процессинга молекулы-предшественника преимущественно путем образования петли из промежуточных последовательностей и сшивания V- и С-областей. Таким образом, формируется молекула мРНК, на которой образуется полипептид Ig. Полагают, что другие вставки в V-области устраняются при сплайсинге ядерной РНК](pic/000094.jpg)
Рис. 7.8. Двухстадийная модель интеграции константной и вариабельной области гена [93]. Стадия 1: перестройка ДНК и коммитирование клеток к V-гену. На этой стадии V- и С-гены ДНК зародышевой клетки разъединены. В антителопродуцирующей клетке эти гены сближаются, но их все-таки разделяет промежуточная нуклеотидная последовательность. Такая перестройка, или транслокация, ДНК представляет собой классическое 'интеграционное' событие, которое позволяет индивидуальной антителообразующей клетке коммитироваться к V-гену. Стадия 2: функциональная интеграция (связывание V- и С-областей в мРНК). На этой стадии в результате транскрипции активированного гена образуется предшественник ядерной РНК, который включает V-, С-области и промежуточную последовательность. Функциональная интеграция V- и С-областей происходит во время процессинга молекулы-предшественника преимущественно путем образования петли из промежуточных последовательностей и сшивания V- и С-областей. Таким образом, формируется молекула мРНК, на которой образуется полипептид Ig. Полагают, что другие вставки в V-области устраняются при сплайсинге ядерной РНК
![Рис. 7.9. Гипотетическая схема экспрессии одного гена VH и многих генов СН [93]. 1. Пул локусов гена VH обозначен набором генов, связанных с несколькими генами СН, расположенными в данном порядке. Для экспрессии выбирается единственный V-ген (VH) и происходит перестройка ДНК, в результате которой гены VXH и С сближаются. Между генами VXH и СН может присутствовать, а может и отсутствовать промежуточная последовательность (обозначена S). В процессе такой перестройки клетка коммитируется к VH-гену и активируется единица транскрипции Н-цепи. 2. В результате транскрипции единицы Н-цепи образуется гигантская молекула предшественника ядерной РНК, которая включает V - С-промежуточную последовательность, VXH-ген и СН-гены. 3. При образовании мРНК в ходе внутриядерного процессинга этой гигантской молекулы может возникать любая комбинация генов VXH и СН. 3а. Например, мРНК VXHCμ может образоваться посредством формирования петли из промежуточной V - С-области, сшивания VXH- и Cμ-областей и деградации оставшейся РНК. 3б. мРНК VXHCδ образуется из того же предшественника формированием петли из последовательностей S и Сμ и сшиванием областей V и Сδ. 3в. Аналогично образуется мРНК VXHCγ. Поэтому одна клетка может одновременно вырабатывать один, два или три вида мРНК с одним и тем же геном VH, но с разными генами СН. Спейсерные последовательности, которые расположены между СН-генами, определяют специфичность процессинга: эти гипотетические последовательности элиминируются при процессинге ядерной РНК. Данная модель является минимальной, так как она не учитывает гены Сα и Сε, которые тоже могут участвовать в подобном процессе благодаря тому, что предшественник гяДНК может содержать один из этих или оба СН-гена](pic/000095.jpg)
Рис. 7.9. Гипотетическая схема экспрессии одного гена VH и многих генов СН [93]. 1. Пул локусов гена VH обозначен набором генов, связанных с несколькими генами СН, расположенными в данном порядке. Для экспрессии выбирается единственный V-ген (VH) и происходит перестройка ДНК, в результате которой гены VXH и С сближаются. Между генами VXH и СН может присутствовать, а может и отсутствовать промежуточная последовательность (обозначена S). В процессе такой перестройки клетка коммитируется к VH-гену и активируется единица транскрипции Н-цепи. 2. В результате транскрипции единицы Н-цепи образуется гигантская молекула предшественника ядерной РНК, которая включает V - С-промежуточную последовательность, VXH-ген и СН-гены. 3. При образовании мРНК в ходе внутриядерного процессинга этой гигантской молекулы может возникать любая комбинация генов VXH и СН. 3а. Например, мРНК VXHCμ может образоваться посредством формирования петли из промежуточной V - С-области, сшивания VXH- и Cμ-областей и деградации оставшейся РНК. 3б. мРНК VXHCδ образуется из того же предшественника формированием петли из последовательностей S и Сμ и сшиванием областей V и Сδ. 3в. Аналогично образуется мРНК VXHCγ. Поэтому одна клетка может одновременно вырабатывать один, два или три вида мРНК с одним и тем же геном VH, но с разными генами СН. Спейсерные последовательности, которые расположены между СН-генами, определяют специфичность процессинга: эти гипотетические последовательности элиминируются при процессинге ядерной РНК. Данная модель является минимальной, так как она не учитывает гены Сα и Сε, которые тоже могут участвовать в подобном процессе благодаря тому, что предшественник гяДНК может содержать один из этих или оба СН-гена
Механизм, по которому все плазматические клетки, образованные клоном В-клеток, вырабатывают иммуноглобулин только одного типа, по-видимому, включает особое расположение специфических молекул Ig на специфических клонах В-лимфоцитов, подходящее для того, чтобы они могли служить рецепторами. Это может происходить во время созревания стволовых клеток в фабрициевой сумке или костном мозге. Связывание специфического антигена со специфическим иммуноглобулиновым рецептором стимулирует деление В-клеток. На этой стадии может также происходить селекция вариабельного гена, константного гена для χ- и λ-цепей и константного гена для Н-цепи с целью синтеза специфического иммуноглобулина.
Легкие и тяжелые цепи транслируются раздельно на полисомах шероховатого эндоплазматического ретикулума плазматических клеток. Легкие цепи ковалентно связываются с новообразованными тяжелыми цепями. Затем молекулы иммуноглобулина проникают в аппарат Гольджи, где в Н-цепи включается углеводный компонент, после чего молекула секретируется плазматической клеткой. Процесс синтеза молекулы Ig завершается за несколько минут. Поскольку весь белоксинтезирующий механизм плазматической клетки запрограммирован на синтез молекул только одного типа, как в случае ретикулоцитов, синтезирующих только глобин, каждая плазматическая клетка способна в 1 с дать несколько тысяч молекул Ig.
|
ПОИСК:
|
© GELIB.RU, 2013-2019
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'