
Теория ошибок
Оргел [88] предложил теорию ошибок, согласно которой ошибки, появляющиеся при передаче информации на этапах транскрипции и трансляции, могут вызвать накопление дефектных белков и привести к старению. К числу ошибок относится включение неправильных нуклеотидов в мРНК во время транскрипции, что может приводить к изменению триплетных кодонов, или включение неправильных аминокислот во время трансляции, из-за чего белки частично или полностью инактивируются. Ошибки в белках, которые сами участвуют в белковом синтезе, таких, как ферменты транскрипции и трансляции, особенно усиливают процесс накопления ошибок в клетках. Эти ошибки могут саморазмножаться, вызвать экспоненциальное увеличение дефектных ферментов и белков и привести к "катастрофе ошибок", следствием которой будет старение и смерть клетки.
Накопление ошибок в ферментах, ответственных за метаболизм, может и не привести к повреждениям, так как эти ферменты имеют короткий период полужизни, вскоре деградируют и ошибка ликвидируется. Если, однако, ошибка появляется в молекуле РНК-полимеразы или аминоацил-тРНК - синтетазы, то это может быть причиной включения неправильных аминокислот во все виды белков, которые синтезирует клетка. Тогда уровень дефектных белков будет экспоненциально нарастать. Например, дефектная РНК-полимераза может способствовать появлению нескольких ошибочных нуклеотидов в мРНК различных типов, из-за чего могут появиться изменения в кодонах. Дефектная аминоацил-тРНК - синтетаза может нагрузить тРНК ошибочной аминокислотой, которая включится в белок вместо другой аминокислоты. Теория ошибок основана на предположении, что механизм передачи информации может повреждаться. Другими словами надежность, или точность, этого механизма не абсолютны и ошибки, однажды возникшие в ферментах белкового синтеза, могут распространяться.
Позже Оргел [89] модифицировал свою теорию и постулировал, что, даже если точность механизма синтеза белка не абсолютна и допускает появление ошибок, такие ошибки не обязательно накапливаются, так как последующие генерации белоксинтезирующего аппарата дискретны. Согласно Оргелу, если Cn означает частоту ошибки в n-й генерации белоксинтезирующего аппарата, R - частоту конечной ошибки и α - константу пропорциональности между числом ошибок в синтезирующем аппарате и во вновь синтезированных белках, то
Cn+l=R+αCn.
Если C0=О, то Cn=R(l+α+α2+...αn-1); если а>1, то С постепенно увеличивается; если а>>1, то частота ошибки увеличивается по экспоненте и вызывает "катастрофу ошибок".
Однако а может не быть больше 1, и тогда "катастрофа ошибок" не будет неизбежной. В таких случаях достигается постоянная частота ошибки, равная R/(1-α) [90]. Возможны две различные ситуации. Предположим, что первая генерация белоксинтезирующего аппарата, который продуцирует аминоацил-тРНК - синтетазу, рибосомные белки и т. д., не допускает ошибок. Так как точность работы аппарата не абсолютна, вторая генерация может допускать несколько ошибок, третья - еще больше и т. д. В ходе этого процесса может возникнуть одна из двух ситуаций: 1) частота ошибок рано или поздно достигнет такого высокого уровня, что клетки не смогут дальше функционировать, произойдет "катастрофа ошибок"; 2) частота ошибок может приблизиться к постоянному положительному значению или достичь равновесного уровня, при котором нельзя будет обнаружить феномен старения. Оргел [90] считает, что клетки могут создавать белоксинтезирующий аппарат, допускающий меньше число ошибок, из аппарата с более высоким уровнем ошибок; они делают это с помощью ферментов, которые убирают ошибочные белки [36], в результате чего происходит стабилизация малой частоты ошибки.
Ряд исследователей провели эксперименты с целью проверить теорию ошибок. Принц и Гросс [95] нашли, что мутант leu-5 Neurospora синтезирует термочувствительный лейцин-активирующий фермент, который при высокой температуре замещает Leu другими аминокислотами в период трансляции. При низкой температуре синтез белка протекает более или менее нормально и Neurospora имеет обычную продолжительность жизни. Однако при повышенной температуре (35°С) мутант раньше подвергается старению. Левис и Холлидей [70] сообщили, что точность синтеза белка снижается, когда этот мутант содержится при 37°С вместо 25. Впрочем, частота ошибок вскоре стабилизируется и остается постоянной значительное время. Однако клетки начинают стареть примерно после 70 ч. Авторы представили данные о том, что при 37°С быстро снижаются термолабильность и удельная активность глутаматдегидрогеназы этого гриба.
Ошибки в синтезе белка могут также возникать вследствие соматических мутаций или наоборот. Поэтому эти два механизма трудно отличить один от другого. Например, ошибки в белоксинтезирующем аппарате могут привести к изменению структуры ДНК-полимер азы, которая в свою очередь может способствовать возникновению ошибок или мутаций в ДНК путем введения неправильных нуклеотидов при репликации [49].
Если накопление ошибок является причиной старения клеток, то необходимо ответить на ряд вопросов. Например, вопрос, который поставил сам Оргел [90], заключается в следующем: почему ошибки не накапливаются в клетках зародышевого пути? Если бы они там накапливались, то виды вымерли бы. Оргел предполагает, что процессы "контроля качества" могут действовать в период оогенеза и раннего развития и приводить к элиминации яйцеклеток или эмбрионов с высоким уровнем ошибок, как это происходит с яйцеклетками человека в пожилом возрасте. Другой вопрос состоит в том, как и почему такой механизм "контроля качества", если он существует, прекращает функционировать после завершения развития? Более того, если возникновение ошибок есть причина старения, прекращения деления клеток и их смерти, то отсюда следует, что трансформированные или опухолевые клетки не должны содержать ошибок. Маловероятно, чтобы репликация ДНК и синтез белка протекали в трансформированных клетках, с абсолютной точностью. Если при трансформации надежность увеличивается, то как это осуществляется?
Старение клеток in vitro рассматривали под другим углом зрения. Культивируемые клетки человека имеют ограниченный потенциал удвоения популяции, тем не менее иногда в культуре появляются клетки, которые делятся неопределенно долго. Кирквуд и Холлидей [68], Холлидей и др. [48] и Кирквуд [67] полагают, что клетки в культуре потенциально бессмертны, но в процессе роста культуры возникают определенные клетки, которые необратимо коммитированы к старению и смерти. Эти клетки какое-то время нормально размножаются, но после "инкубационного периода" М (который определяется числом делений между коммитированием и смертью) они стареют и погибают. Некоммитированные клетки продолжают делиться.
Предполагается, что клеточная популяция первоначально не коммитирована и может расти без ограничения, удваивая свой объем с каждым следующим делением до тех пор, пока при (М+1)-м делении не появятся погибшие клетки из числа первых коммитированных, которые уже достигли конца инкубационного периода. Тогда рост популяции замедляется и в дальнейшем зависит от значения фактора вероятности Р.
Если вероятность коммутирования и инкубационный период достаточно велики (Р>0,5), то число некоммитированных клеток в популяции прогрессивно снижается до 1 на 106 клеток, в итоге клетки погибают и выбывают из популяции. К этому времени все оставшиеся клетки коммитированы к старению, отчего популяция и становится смертной. Если вероятность коммитирований мала (Р<0,5) или продолжительность инкубационного периода невелика, то популяция может перейти в состояние устойчивого равновесия, при котором в ней будут находиться в постоянных соотношениях небольшая часть некоммитированных клеток, большое количество коммитированных и постоянная доля нежизнеспособных клеток. Размер клеточной популяции, таким образом, прямо связан с вероятностью потери последних некоммитированных клеток в культуре. Однако при обычной методике культивирования размер культуры ограничен и избыток клеток отбрасывается; если объем культуры не очень велик, то некоммитированные клетки теряются при "разведении". Обычно культуры содержат 106-107 клеток. Экспериментальные данные показывают, что если Р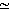 0,275, то М
0,275, то М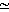 55-60. В зависимости от величин Р, М и числа клеток культуры либо растут непрерывно с постоянным уровнем коммитированных, некоммитированных и отживающих клеток, либо стареют и погибают. В связи с изложенным возникает ряд вопросов. Почему клетки становятся коммитированными и прекращают деление? Что влияет на этот процесс - геном или цитоплазм этические факторы? Иногда действительно в культуре находят фибробласты, которые делятся непрерывно, но они, как правило, отличаются от нормальных клеток необычным числом хромосом. Коммитирование клеток перед дифференцировкой происходит в раннем периоде развития, в результате чего некоторые клетки становятся неделящимися, т. е. постмитотическими. Это относится к нейронам, клеткам скелетной и сердечной мышц, которые синтезируют определенные белки и выполняют специфические функции. Вместе с тем некоторые клетки продолжают делиться на протяжении всей жизни, например клетки костного мозга и эпителия. Клетки того и другого типа, таким образом, являются коммитированными; как полагают, коммитирование возникает в результате дифференциальной экспрессии генов, что зависит от расположения клеток, а также от вне- и внутриклеточных факторов. Холлидей и др. [48] и Кирквуд [67] не объясняют, по какой причине клетки коммитируются к старению.
55-60. В зависимости от величин Р, М и числа клеток культуры либо растут непрерывно с постоянным уровнем коммитированных, некоммитированных и отживающих клеток, либо стареют и погибают. В связи с изложенным возникает ряд вопросов. Почему клетки становятся коммитированными и прекращают деление? Что влияет на этот процесс - геном или цитоплазм этические факторы? Иногда действительно в культуре находят фибробласты, которые делятся непрерывно, но они, как правило, отличаются от нормальных клеток необычным числом хромосом. Коммитирование клеток перед дифференцировкой происходит в раннем периоде развития, в результате чего некоторые клетки становятся неделящимися, т. е. постмитотическими. Это относится к нейронам, клеткам скелетной и сердечной мышц, которые синтезируют определенные белки и выполняют специфические функции. Вместе с тем некоторые клетки продолжают делиться на протяжении всей жизни, например клетки костного мозга и эпителия. Клетки того и другого типа, таким образом, являются коммитированными; как полагают, коммитирование возникает в результате дифференциальной экспрессии генов, что зависит от расположения клеток, а также от вне- и внутриклеточных факторов. Холлидей и др. [48] и Кирквуд [67] не объясняют, по какой причине клетки коммитируются к старению.
Кирквуд [67] предположил, что коммитирование соматических клеток в культуре может быть вызвано накоплением ошибок, так как этот процесс хуже регулируется вне организма. Он утверждает, что ошибки внутренне присущи всем процессам передачи макромолекулярной информации: "Для того, чтобы поддерживать дальнейшие эволюционные изменения и таким образом увеличивать возможность максимального выживания, любой организм должен совершать случайные ошибки кодирования". Создается впечатление, что организм знает, что он должен эволюционировать, и поэтому делает ошибки. Этот взгляд близок к идеям Вейсмана, которые были дискредитированы. Знает ли организм, где и когда делать ошибки, чтобы эволюционировать? Правда, если точность системы переноса информации была бы абсолютной, то, вероятно не было бы эволюции. Хоффман [47] сообщил, что механизм трансляции исключает ошибки, и, следовательно, "катастрофа ошибок" здесь невозможна. Кирквуд и Холлидей [68] указывают на нереальность такой точки зрения; они предполагают, что белоксинтезирующий аппарат может стабильно работать, даже: если он ошибается. Если обозначить общий уровень ошибок буквой R, то при малых значениях этой величины процесс накопления ошибок достигает стационарного состояния, а при больших R приводит к "катастрофе ошибок". Кирквуд и Холлидей считают, что эти явления лежат в основе эволюции. Мартин и др. [80] предположили, что in vivo клетки сохраняют способность к делению даже в старом возрасте. Средняя продолжительность жизни культуры (число удвоений популяции) составляет ∼ (42-0,2 X), где X - возраст донора. Следовательно, клетки даже 90-100-летнего индивидуума способны к 20-25 удвоениям популяции. Кирквуд [67] считает, что, как только клетки в культуре становятся коммитированными, размер популяции резко падает. Сходное положение может возникнуть in vivo, в результате чего орган теряет клетки, а следовательно, и активность. Это может быть обусловлено переходом белоксинтезирующего аппарата от стабильного состояния к нестабильному и появлением ошибок в белках.
По предположению Хопфилда [60] можно избежать ошибок репликации путем затраты дополнительной энергии на тщательное считывание информации или на разрушение дефектных макромолекул. "Ферменты-чистильщики" могут удалять ошибочные белки. Точность синтеза в клетках зародышевого пути, необходимая для сохранения наследственной информации, для соматических клеток не столь существенна. Если в соматических клетках будет поддерживаться большая точность синтеза, то затраты энергии будут слишком велики. Кирквуд [67] предположил, что старение может быть следствием выключения механизмов, ответственных за высокую точность работы аппарата трансляции до или во время дифференцировки соматических клеток; этим достигается экономия энергии. Таким образом, соматические клетки функционируют в нестабильном режиме, происходит постепенное нарастание числа ошибок, что приводит через некоторое время к старению и "катастрофе ошибок". Однако известно, что отмирают и эмбриональные клетки (гл. 1). Почему именно эти, а не другие клетки коммитируют к старению на такой ранней стадии, почему возникают ошибки и что регулирует их уровень? Приведенные доводы не объясняют различий между клетками разных типов, такими, как нейроны и мышечные клетки, которые полностью прекращают деление, или клетки печени, которые постоянно медленно пролиферируют, или эпителиальные и кроветворные клетки, которые интенсивно делятся в течение (Всей жизни. Кроме того, связь между старением клеток in vitro и старением всего организма сомнительна, было показано, что фибробласты цыплят и человека имеют ограниченную продолжительность жизни, в то же время фибробласты быка, кролика, хомяка, крысы и мыши обладают неограниченной способностью к делению, хотя если потенциал удвоения популяции имеет какое-нибудь отношение к продолжительности жизни, можно было ожидать, что у этих клеток он должен быть меньше.
Ряд экспериментальных данных противоречит возможности появления ошибок в белках в таких количествах, которые могли бы вызвать старение или "катастрофу ошибок". Канунго и Ганди [59] сравнивали малатдегидрогеназу печени молодых и старых крыс иммунологическими методами. Они не обнаружили возрастных различий в свойствах ферментов. Следовательно, ген малатдегидрогеназы не подвергается с возрастом никаким структурным изменениям. Кинетические, электрофоретические и иммунологические исследования ацетилхолинэстеразы головного мозга [84] и аланинаминотрансферазы печени [93] также показали отсутствие явных возрастных различий. В дальнейшем это заключение подтвердилось тем, что карты триптических гидролизатов актина и миозина скелетной мышцы молодых, взрослых и старых (8, 21 и 84 нед) крыс оказались одинаковыми [117]. Очевидно, первичная структура ферментов при старении не изменяется.
Позже в исследованиях альдолазы из печени мыши [32,33] и цитоплазматической пероксид-дисмутазы из печени головного мозга и сердца крыс и мышей [97, 99] было показано, что антигенность, Км, Ki, электрофоретическая подвижность в полиакриламидном геле и полиакриламидном геле с додецилсульфатом натрия одинаковы для молодых и старых животных. Более того, при изоэлектрофокусировании этих ферментов не ВЫЯВИЛИ никаких различий в их электрических зарядах [39]. Наблюдали только различия в таких свойствах, как удельная активность фермента (ед/мг белка), которая была понижена у старых особей, и чувствительность к температуре, которая была повышена. Эти сдвиги были отнесены к посттрансляционным химическим изменениям типа фосфорилирования, ацетилирования, дезаминирования, аденилирования, окисления SH-групп и т. д., которые не определяются при электрофорезе в полиакриламидном геле [30]. Такие измененные молекулы имеют пониженную удельную активность и с возрастом накапливаются.
Однако сообщалось о различиях в антигенных свойствах альдолазы и глюкозо-6-фосфат-дегидрогеназы из эритроцитов молодых и старых людей [55, 82]. Частоты соматических мутаций, установленные по изменениям глюкозо-6-фосфат-дегидрогеназы [27] и хромосомным отклонениям [125], значительно выше у старых животных. Ягил [131] показал, что электрофоретическая подвижность, электроиммунодиффузия и чувствительность к температуре глюкозо-6-фосфат - дегидрогеназы печени одинаковы у молодых и старых мышей.
Исследования Гершона и его коллег показали близость величин Км, Ki, молекулярной массы и электрофоретической подвижности изоцитрат-лиазы [31] и альдолазы [133] у молодых и старых особей свободноживущей нематоды Turbatrix aceti. Однако ферменты старых животных обладали пониженной антигенностью и удельной активностью. Ротстайн и сотрудники изучили ряд ферментов молодых и старых Turbatrix aceti: изоцитрат-лиазу (рис. 9.4) [100], енолазу [111-113], триозофосфатизомеразу и фосфоглицераткиназу [40, 41], и в каждом случае молекулярная масса, Км, термостабильность и электрофоретическая подвижность были сходными. Каталитическая активность, однако, была ниже в старом возрасте, что, как предположили авторы, может быть вызвано полной инактивацией молекул фермента, но не включением ошибочных аминокислот. Возрастные изменения изоцитрат-лиазы, енолазы и фосфоглицераткиназы были также исследованы в гомогенной популяции Turbatrix aceti; гомогенность культуры достигалась удалением вновь появляющихся особей через равные интервалы времени. В старом возрасте каталитическая активность всех исследованных ферментов снижалась. Кроме того, енолаза старых особей отличалась по антигенности от фермента молодых животных [113]. На основе этих данных Ротстайн [105, 106] предположил, что наблюдаемые различия вызваны конформационными изменениями, но не замещением аминокислот.
![Рис. 9.4. Зависимость общей активности изоцитрат-лиазы, преципитированной данным количеством антител, от возраста круглого червя Tyrbatrix aceti [100]](pic/000113.jpg)
Рис. 9.4. Зависимость общей активности изоцитрат-лиазы, преципитированной данным количеством антител, от возраста круглого червя Tyrbatrix aceti [100]
Были сделаны попытки определить накопление ошибок в белках в зависимости от возраста культивируемых фибробластов. Холлидей и Террент [49] описали увеличение доли неактивной и термолабильной глюкозо-6-фосфат - дегидрогеназы на поздних пассажах фибробластов MRC-5. Лактатдегидрогеназа фибробластов поздних пассажей этой линии отличалась по антигенности от фермента ранних пассажных клеток [71]. Голдстайн и Мёрмен [37] представили сходные данные по трем ферментам фибробластов кожи человека. Имеются данные не только о значительном уменьшении точности работы ДНК-полимеразы в клетках поздних пассажей (что изучалось с помощью синтетических матриц), но и об уменьшении скорости элонгации репликона [73]. Большой процент ошибок, регистрируемый этими авторами, вряд ли присущ нормальным клеткам; поскольку он был бы для них катастрофичным, не исключено, что регистрируемая неточность считывания обусловлена использованием в качестве матриц синтетических полинуклеотидов. Мартин и др. [79] не обнаружили различий в термочувствительности и антигенности ферментов клеток ранних и поздних пассажей в культуре WI-38. Следовательно, иммунные и каталитические свойства, а также положение при электрофокусировании фосфоглицераткиназы, пируваткиназы типа М2, глюкозофосфатизомеразы и глюкозо-6-фосфат - дегидрогеназы не отличаются у фибробластов ранних и поздних пассажей. Не изменяется также скорость, а следовательно, и надежность репликации вирусов.
Ферменты β-N-ацетилглюкозаминидаза, α-глкжозидаза и α-N-ацетилгалактозаминидаза лизосом и NADH-дегидрогеназа митохондрий молодых и старых фибробластов WI-38 имеют сходную термолабильность [52]. РНК-полимераза, которая участвует в синтезе белка и, согласно Оргелу, является одним из основных виновников появления ошибок, была изучена Ивенсом [25]. Он не нашел различий в термолабильности и удельной активности ферментов, полученных из молодых и старых клеток.
Гервин и др. [29] измерили ошибки считывания poly (U) in vitro в неочищенных препаратах, полученных в различное время из E. coli, растущей в присутствии дигидрострептомицина, который, как известно, вызывает ошибки трансляции. Они наблюдали значительное увеличение ошибок считывания poly (U), но их уровень достигал стабильных значений в присутствии антибиотика в течение нескольких генераций. Исследования Эделмена и Гелланта [24] in vivo дали сходные результаты. Оценка ошибочной трансляции (включение цистеина в флагеллин) у E. coli в присутствии стрептомицина показала, что частота ошибки становится в 50 раз выше, чем в норме, и затем стабилизируется на одном уровне (рис. 9.5). Таким образом, даже если ошибки появляются в процессе трансляции, то, как и предполагали Гоел и Икес [35], достигается стабилизация ее точности. Поэтому маловероятно, чтобы первопричиной старения было возникновение ошибок в процессе переноса информации.
![Рис. 9.5. Кинетика частоты ошибки в присутствии и в отсутствие стрептомицина [24]. Культура АС92 была выращена в отсутствие стрептомицина, и в ней была измерена частота фоновой ошибки. В момент, отмеченный стрелкой, добавляли 5 мкг/мл стрептомицина и измеряли частоту ошибки на протяжении более чем восьми последующих генераций. После двух генераций в присутствии стрептомицина из культуры отбирали аликвоту, отмывали минимальной средой без добавок для удаления стрептомицина и ресуспендировали в среде с добавками. Снова вычисляли частоту ошибки. Культуру метили 3Н-аланином (53 Ки/ммоль) и 35S-сульфатом (2 мКд/нмоль) и выделяли флагеллин, как описано ранее [24]. Сплошная линия и темные значки - частота ошибок в клетках, растущих в присутствии стрептомицина; штриховая линия и светлые значки - частота ошибок в клетках после удаления стрептомицина; светлые и темные кружки и треугольники обозначают данные, полученные в двух экспериментах. Длина горизонтальных линий на значках указывает на фракции той генерации, в пределах которой включалась метка](pic/000114.jpg)
Рис. 9.5. Кинетика частоты ошибки в присутствии и в отсутствие стрептомицина [24]. Культура АС92 была выращена в отсутствие стрептомицина, и в ней была измерена частота фоновой ошибки. В момент, отмеченный стрелкой, добавляли 5 мкг/мл стрептомицина и измеряли частоту ошибки на протяжении более чем восьми последующих генераций. После двух генераций в присутствии стрептомицина из культуры отбирали аликвоту, отмывали минимальной средой без добавок для удаления стрептомицина и ресуспендировали в среде с добавками. Снова вычисляли частоту ошибки. Культуру метили 3Н-аланином (53 Ки/ммоль) и 35S-сульфатом (2 мКд/нмоль) и выделяли флагеллин, как описано ранее [24]. Сплошная линия и темные значки - частота ошибок в клетках, растущих в присутствии стрептомицина; штриховая линия и светлые значки - частота ошибок в клетках после удаления стрептомицина; светлые и темные кружки и треугольники обозначают данные, полученные в двух экспериментах. Длина горизонтальных линий на значках указывает на фракции той генерации, в пределах которой включалась метка
В заключение можно сказать, что существует очень много данных о снижении в пожилом возрасте на 30-70% удельной активности альдолазы А и В [32, 33] и пероксид-дисмутазы у крыс [[98, 99], а также изоцитрат-лиазы [31, 100], фруктозобисфосфат-альдолазы [133], енолазы [111] и фосфоглицераткиназы [41] у Turbatrix aceti. Для нескольких ферментов установлены различия в термолабильности и антигенных свойствах. Вместе с тем удельная активность триозофосфатизомеразы Turbatrix aceti [40] и орнитиндекарбоксилазы печени крыс [86, 87] не изменяется.
При измерении других параметров перечисленных ферментов: Км, Ki, электрофоретической подвижности и молекулярной массы никаких существенных различий не обнаружено. Каковы же причины возрастных изменений свойств ферментов? Использование совершенной методики типа изоэлектрофокусирования, с помощью которой можно разделять белки, отличающиеся только суммарным электрическим зарядом, не выявило никаких отличий между пероксид-дисмутазами молодых и старых крыс [39, 98, 99]. Более того, когда провели двумерное картирование белков верхних шейных нервных узлов молодых и старых крыс, также не нашли никаких различий, причем в одном направлении белки разделялись в соответствии с их изоэлектрической точкой, а в другом - в соответствии с их молекулярной массой [129]. Триптические карты актина и миозина скелетной мышцы молодых и старых крыс оказались одинаковыми [117].
Таким образом, имеются убедительные данные, которые показывают, что с увеличением возраста ошибки типа замещения аминокислот в белках не возникают в сколько-нибудь существенном количестве ни in vivo, ни in vitro. Появление ошибок является случайным процессом, и если бы они возникали, то существовали бы белки с замещенными аминокислотами, однако такие белки не обнаружены. Кроме того, более или менее постоянную продолжительность жизни видов и постепенное ослабление функции с увеличением возраста нельзя объяснить теорией ошибок, так как для того, чтобы иметь отношение к упомянутым феноменам, ошибки должны возникать с определенной скоростью. Приходится предполагать, что частота ошибок регулируется генами или другими факторами, что противоречит основной идее теории ошибок. Следовательно, маловероятно, чтобы причиной старения было нарастание ошибок в функциональных макромолекулах с возрастом.
Что же тогда служит причиной снижения удельной активности и увеличения термолабильности ферментов, наблюдаемых я пожилом возрасте? Считают, что эти изменения могут появляться в результате незначительных посттрансляционных модификаций белков типа гликозилирования, метилирования и т. д., которые не меняют суммарного электрического заряда молекулы [30]. Это возможно в том случае, если увеличение с возрастом времени полужизни T½ ферментов обусловлено снижением скорости их деградации. В этом случае молекулы сохраняются дольше и в большей степени подвергаются действию трансфераз, трансаминаз и т. д. Величина T½ белков будет возрастать, если снижается активность протеаз. Следовательно, необходимо объяснить, почему в старческом возрасте снижается активность ферментов деградации типа протеаз. Таким образом, рассмотренные гипотезы (теория ошибок и посттрансляционных изменений) являются поверхностными, они не вскрывают основной причины старения.
|
ПОИСК:
|
© GELIB.RU, 2013-2019
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'