
Глава VI. Зависимость продолжительности жизни от генетических факторов

Зависимость продолжительности жизни от генетических факторов

Видовая (максимальная) продолжительность жизни землеройки составляет около двух лет, а продолжительность жизни другого вида млекопитающих - слона - почти в 50 раз больше. Какова причина этих различий? Может быть, дело в массе тела организма? Но человек тоже принадлежит к плацентарным млекопитающим, его масса во много раз меньше массы слона, а видовая продолжительность жизни обоих примерно одинаковая.
Далее, продолжительность жизни лабораторных животных одного вида, но разных линий (у которых не только масса тела, но и почти все морфологические и физиологические показатели практически одинаковы) может различаться почти в 2 раза. Причем такое различие наблюдается даже и тогда, когда животные находятся в фактически одинаковых условиях (в вивариях). Следовательно, в этих случаях различия в продолжительности жизни определяются генетическими факторами. Но это во-первых. Во-вторых, о сильной зависимости продолжительности жизни от генетических факторов свидетельствуют относительно небольшие ее различия у однояйцевых близнецов, несмотря на часто несхожие условия, в которых они оказываются. В пользу этого же говорит и прямая корреляция между продолжительностью жизни родителей и их потомков.
Тот факт, что продолжительность жизни животных, принадлежащих к одному виду, хотя и варьирует, но все же не превышает определенного уровня, характерного для данного вида, может означать одно: этот видовой признак, как и другие, имел эволюционное значение. Начиная с Вейсмана, ряд генетиков и биологов других специальностей, разрабатывавших эволюционное учение, полагали, что эволюция должна идти в сторону сокращения продолжительности жизни. Однако результаты анализа таких изменений у млекопитающих, особенно у приматов, резко противоречат такому заключению. Можно даже сформулировать противоположный вывод: по мере усложнения центральной нервной системы и развития интеллекта в процессе эволюции происходило увеличение продолжительности жизни.
Факты, подтверждающие это, были рассмотрены в первом издании книги. Тогда же были сформулированы и пояснены эволюционные закономерности, позволяющие хотя бы предположительно определить биологические (генетические, молекулярные, клеточные) и физиологические основы долголетия.
Вкратце напомню эти закономерности, прежде чем привести факты, полученные в последнее десятилетие и позволяющие глубже понять некоторые из них. Первая закономерность характеризует морфологические критерии долголетия и состоит в том, что оно тем больше, чем больше относительный вес мозга. Такая закономерность обнаруживается при сравнении животных одного вида, но различных линий или пород (у собак).
Вторая закономерность - обратная корреляция между продолжительностью жизни и скоростью развития организма. Такую корреляцию удается выявить при сравнении животных различных видов, а также разных линий внутри одного вида.
Один из подходов, использованных и в последнее десятилетие для выяснения роли определенных генетических факторов в долголетии, - анализ результатов экспериментов, в которых вели отбор животных по такому признаку, как увеличенная продолжительность жизни. Такого рода исследования были проведены, в частности, на плодовой мушке-дрозофиле (в этих опытах вели отбор производителей с замедленной скоростью реализации репродуктивного потенциала) и нематодах. И их результаты показывают: снижение жизнеспособности организмов с возрастом определяется генетическими факторами, точнее, распространением в популяции таких генов, вредные эффекты которых проявляются в позднем возрасте.
У норвежских чернокапюшонных крыс исследована также корреляция между долголетием отдельных животных и их поведенческими реакциями или динамикой роста. Четкой корреляции между скоростью роста и продолжительностью жизни не было обнаружено; однако было найдено, что чем раньше крысы "набирали" свой максимальный, характерный для данного вида вес, тем меньше была их продолжительность жизни. Наибольшей же она была у животных с высокими показателями уровня неспецифической возбудимости и эмоциональной реактивности.
Хотя мы стремимся вычленить роль в долголетии только генетических факторов (влияние на него внешних факторов будет рассмотрено в следующей главе), уместно сейчас рассказать о следующем исследовании.
Зависимость между скоростью роста и продолжительностью жизни была изучена в эксперименте на дрозофиле путем изменения тремя различными способами количества потребляемой пищи на стадии личинки, а также посредством изменения температуры окружающей среды. Оказалось, что связь между скоростью роста (личинки) и продолжительностью жизни взрослой особи (имаго) описывается уравнением квадратичной параболы с максимумом средней продолжительности жизни при скорости увеличения массы тела, равной 50 мкг в день. Эти данные заставляют уточнить положение о том, что существует однозначная (обратная) зависимость между скоростью роста и продолжительностью жизни. Сопоставляя эти данные с тем, что было сказано о зависимости продолжительности жизни от скорости развития, контролируемой генетическими факторами, мы видим: "искусственное" изменение определенного свойства, связанного с долголетием, отнюдь не эквивалентно естественному изменению, закрепленному эволюцией.
Третья закономерность, а точнее, группа закономерностей, сформулированных в первом издании этой книги, касается устойчивости генома и способности клеток к репарации ДНК. Оказывается, чем больше эта устойчивость (оцениваемая по величине обратной абсолютной скорости мутаций на генном или хромосомном уровне) или больше способность к репарации ДНК (оцениваемая по интенсивности и максимальному уровню репаративного синтеза ДНК), тем больше видовая продолжительность жизни в ряду различных видов млекопитающих, начиная от землеройки и кончая слоном и человеком (см. рис. 7).
В последние годы был выполнен ряд работ с культивируемыми клетками этих организмов и получены факты, подтверждающие прямую связь между способностью к репарации ДНК и. долгожительством. Прежде чем приводить эти факты, ради строгости анализа, особенно необходимого в данном случае, сделаю оговорку. В Японии была выношена работа, данные которой свидетельствовали как будто о том, что такой связи не существует. Но внимательный анализ методики, использованной в этой работе, показал, что здесь имелись погрешности. Это позволяет считать, что результаты данной работы не пошатнули общей закономерности.
Одной из самых интересных является работа американских биогеронтологов Р. Харта и Р. Л. Вэлфорда с сотрудниками, исследовавших способность к эксцизионной репарации ДНК у клеток наших "близких родственников" - приматов. Были изучены клетки обезьян семи видов, существенно различающихся по продолжительности жизни. Причем такую способность определяли у двух различных типов клеток исследованных организмов: у лимфоцитов периферической крови и фибробластов кожи, культивируемых in vitro. В обоих случаях обнаружена прямая корреляция между способностью к репарации ДНК и величиной максимальной (видовой) продолжительности жизни.
В 1985 году другая группа американских авторов (Карол Дж. Масланский и Гарри М. Вилльямс) изучили способность к репарации повреждений ДНК, вызванных УФ-излучением у гепатоцитов, полученных от пяти видов млекопитающих, различающихся по продолжительности жизни: мышей и сирийских золотистых хомячков (максимальная продолжительность жизни три года), крыс (четыре года), морских свинок (семь лет) и кроликов (13 лет). Определяли два параметра, характеризующих количественно способность популяции клеток к репарации ДНК: долю клеток, участвующих в репаративном синтезе, и его интенсивность. При относительно низких дозах облучения (2,5 и 5 Дж/м2) гепатоциты мышей и крыс обладали меньшей способностью к репарации ДНК, чем гепатоциты морских свинок или кроликов. В соответствии с нашей концепцией американские авторы полагают, что клетки относительно более долгоживущих видов животных обладают и относительно большей способностью к репарации ДНК и, следовательно, процесс старения организмов определяется и накоплением повреждений ДНК.
Также в 1985 году были исследованы видовые особенности ферментных систем, катализирующих не эксцизионную, а одноэтапную репарацию ДНК. Из ферментов, участвующих в такой репарации, наиболее изучена алкилтрансфераза - фермент, осуществляющий перенос алкильных групп с ДНК на свою определенную химическую группу. Но алкилирование макромолекул обычно существенно нарушает их функцию, поэтому в процессе работы трансферазы происходит не только восстановление (залечивание повреждения) ДНК, но и повреждение (а точнее, инактивация) молекулы фермента. Последний совершает своеобразное "самоубийство", спасая свой субстрат - молекулу ДНК.
Так вот, группа ученых в Королевском центре противораковых исследований в Лондоне (Джанет Холл с соавторами) обнаружила: экстракты из печени человека и обезьян в 8-10 раз эффективнее удаляют метальные группы, присоединенные по 6-му кислородному атому гуанина ДНК, чем экстракты из печени крыс.
А в Международном центре по исследованию механизмов канцерогенеза (Лион) Рихард Веклер и Ругеро Монтесано, занимавшиеся изучением способности экстрактов печени различных млекопитающих удалять метальные группы, присоединенные к 4-му кислородному атому дезокситимидина полинуклеотида определенного состава, также пришли к интересным выводам. Предполагается, что такая репарация катализируется специальной метилтрансферазой. Но независимо от механизма репарации примечателен тот факт, что способность тканей катализировать этот процесс уменьшается в ряду: печень человека, обезьяны, печень крысы после частичной гепатэктомии, нормальная печень крысы. Таким образом, снова обнаруживается закономерность: способность к репарации ДНК больше у долгоживущих видов млекопитающих.
Примечательно и следующее обстоятельство. Алкилирование ДНК по кислородному атому ее оснований имеет определяющее значение в мутагенном и канцерогенном действии алкилирующих агентов. И не случайно поэтому именно ведущие научные центры по исследованию механизмов канцерогенеза изучают рассматриваемые ферменты. Но почему ученые в этих центрах заинтересовались видовыми особенностями активностей репарирующих ферментов? Скорее всего, потому, что становится очевидной связь между старением организма и снижением при этом способности его клеток к репарации ДНК, а это снижение все большее число исследователей склонны считать причиной увеличения предрасположенности организма к тяжелым заболеваниям.
Такие закономерности частично объясняют связь между видовой продолжительностью жизни и способностью к репарации ДНК. В отделе молекулярной эпидемиологии одного из ведущих лечебных комплексов Нью-Йорка Рональд Перо с соавторами (1985) изучил активность еще одного фермента, играющего определенную роль в репарации ДНК. Этот фермент - АДФ-рибозил-трансфераза катализирует процесс ковалентного присоединения АДФ-рибозы из НАД к белкам хроматина. Одно из следствий такой реакции - изменение структуры хроматина, регулирующей доступность репарирующих ферментов к поврежденной ДНК, а также активности самих ферментов, участвующих в эксцизионной репарации ДНК. Уже относительно давно показано, что после облучения ионизирующей радиацией активность АДФ-рибозил-трансферазы возрастает. Но оказывается, что среди лейкоцитов 12 видов млекопитающих существует достоверная корреляция между степенью такой активации этого фермента и видовой продолжительностью жизни организма.
Таким образом, способность к репарации повреждений ДНК, эффективность работы ферментов, обеспечивающих эту способность, - одна из биологических основ долголетия и, вероятно, устойчивости к некоторым тяжелым хроническим заболеваниям. Это заключение согласуется с многочисленными данными, рассмотренными нами в предыдущих главах и свидетельствовавшими о критической роли повреждений ДНК в развитии и преждевременного, и естественного старения, об их роли в развитии спонтанных и вызванных внешними воздействиями злокачественных опухолей, о том, что определенные системы репарации ДНК устраняют такие повреждения и тем самым защищают и от канцерогенных, и сеногенных (т. е. способствующих преждевременному старению) воздействий на организм.
Но устойчивость генетического аппарата к факторам, способным нарушить его целостность и функцию, примерно лишь наполовину определяется системами, залечивающими повреждения ДНК. Как мы теперь знаем, эта устойчивость в значительной степени зависит от метаболизма, в частности от интенсивности образования в клетках и тканях активных форм кислорода, а также от эффективности защиты от них.
Если это так, то биологической основой долгожительства должен быть генетически запрограммированный и закрепленный тренировкой "экономный" биоэнергетический статус организма, при котором относительно невелик уровень активных форм кислорода и других, в частности, обусловленных этими формами генотоксических агентов. В простейшем случае это означает, что, чем меньше кислорода требуется "метаболизировать" организму для обеспечения высокоэнергетическими соединениями (синтезируемыми в процессе окисления кислородом различных субстратов) своих функций, тем, следовательно, менее уязвимо его генетическое вещество и тем должно быть больше долголетие организма. Сформулированное следствие из теории в основном и с определенными уточнениями подтверждается эмпирически выведенной закономерностью об обратной корреляции между продолжительностью жизни млекопитающих различных видов и интенсивностью их метаболизма. На существование такой закономерности еще в начале XX века обратил внимание немецкий биолог М. Рубнер. Получалось так, будто любой вид млекопитающих на протяжении жизни затрачивает одно и то же количество энергии в расчете на единицу массы тела и, исчерпав этот "энергетический жизненный потенциал" (определение, данное уже в 1984 году выдающимся американским биогеронтологом Рихардом Катлером), организм "должен" погибнуть. Общее количество энергии, затраченной на поддержание метаболизма (или эквивалентное ему количество поглощенного О2) в расчете на 1 г массы тела для многих исследованных видов млекопитающих составляет согласно последним данным 220±73 ккал.
Однако из сформулированного правила можно найти исключения. Так, для многих приматов энергетический жизненный потенциал составляет 458±89 ккал, а для человека, обезьян капуцина и лемура еще больше - 781±37 ккал.
Другое замечание (уже практического характера) состоит в следующем. Хорошо известно, что интенсивность обмена веществ или скорость поглощения О2 зависит от двигательной активности (частота дыхания бегущего человека значительно больше, чем находящегося в состоянии физического покоя). Не означает ли это, что, чем больше двигательная активность, тем за меньший промежуток времени истратится "энергетический жизненный потенциал"? Вероятно, так считали О. Бальзак, создавая "Шагреневую кожу" и, разумеется, ничего не зная о приведенных здесь величинах "энергетического жизненного потенциала".
Однако представления о том, что организм, подобно машине, тратит в течение жизни предопределенное количество энергетического фонда, неправильно. Мы уже говорили о том, что биоэнергетический статус организма определяется не только генотипом, но и тренировкой. Да, организм можно научить более экономно тратить "энергетический жизненный потенциал", и люди, вероятно, достигают этого посредством увеличения двигательной активности. Парадокс состоит в том, что для снижения скорости растрачивания потенциала необходимы его траты. Такое заключение подкрепляется результатами многолетних исследований лаборатории возрастной физиологии и патологии, руководимой выдающимся отечественным онтофизиологом и биогеронтологом И. А. Аршавским. На основании этих результатов И. А. Аршавский заключил, что, во-первых, двигательная активность в пределах физиологического стресса является фактором индукции избыточного анаболизма (усиления биосинтетических процессов) и, во-вторых, развитие организма "в условиях действия ограниченной двигательной активности или в условиях избыточного действия двигательных нагрузок, выходящих за пределы физиологического стресса", определяет преждевременное старение и снижение продолжительности жизни.
Таким образом, неодинаковая продолжительность жизни у разных видов млекопитающих может быть объяснена различием их "энергетических потенциалов" и известным правилом о благотворном влиянии на организм физических тренировок. Оказывается, что оба правила соответствуют друг другу. Способность организма к адаптации на различных уровнях его организации (в том числе и молекулярно-клеточном) - вот то ключевое свойство, которое позволяет объяснить сформулированное здесь "противоречие" и многие другие биологические парадоксы. Поэтому-то среди млекопитающих с относительно большой естественной двигательной активностью величина основного обмена (или количество О2, поглощаемого в состоянии покоя) может быть меньше, чем у животных с относительно небольшой естественной двигательной активностью.
Проведенный нами анализ биологических закономерностей позволяет считать низкую физическую активность фактором, отнюдь не способствующим долголетию. Но теперь нельзя согласиться и с теми, кто ратует за резкое увеличение двигательной активности. Это увеличение должно быть умеренным, тренирующим механизмы регуляции метаболизма в пределах адаптационных способностей организма (или в пределах физиологического стресса, по выражению И. А. Аршавского), а не только истощающим энергетический жизненный потенциал. Но адаптационная способность организма в существенной степени зависит от его генетической конституции. Таким образом, пределы благотворного действия и интенсивности двигательной активности должны быть для разных людей различными.
Вопрос о конкретных путях определения индивидуальных оптимальных физических нагрузок уже выходит за рамки проблем, обсуждаемых в этой книге. Наша задача состояла в том, чтобы найти молекулярные основы для поиска такого оптимума и для дополнительной количественной характеристики адаптационной способности организма. Одной из таких характеристик может служить величина отношения скорости образования кислородных радикалов, Н2О2, перекисей липидов к концентрации защитных ферментов (особенно супероксиддисмутазы) и низкомолекулярных антиоксидантов. Если в условиях достаточно полного энергетического обеспечения клеток и тканей это отношение мало, то можно говорить о высокой адаптационной способности.
Теперь мы можем дать хотя бы предположительное объяснение, почему энергетический жизненный потенциал у приматов в 2 раза больше, чем у остальных видов млекопитающих, а у человека он даже больше в 3,5 раза. В значительной степени потому, что эффективность защиты от активных форм кислорода и других рассмотренных нами ранее эндогенных токсических метаболитов у человека больше, чем у большинства других приматов, а у последних больше, чем у других видов млекопитающих. Долголетие, вероятно, определяется, в частности, эффективностью работы ферментативных систем защиты, прежде всего супероксиддимутазы, о которой речь шла в IV главе.
Эту мысль я обосновал в докладе, прочитанном на первом Международном совещании по проблеме надежности биологических систем, состоявшемся летом 1979 года в городе Каневе. Доклад так и назывался "Эволюционный анализ механизмов, определяющих видовую продолжительность жизни животных". Супероксиддисмутаза была названа тогда одним из наиболее эффективных факторов таких механизмов. Правда, привести экспериментальное доказательство этому положению в те годы еще было невозможно, и пришлось опираться на концепцию о роли супероксидных радикалов в старении, обоснованную мною десятилетием раньше (книга "Молекулярные механизмы старения").
Сегодня такое доказательство имеется, причем уже проведен ряд исследований связи, с одной стороны, между активностью супероксиддисмутазы, а с другой - долголетием или жизнестойкостью организмов (см. главу IV).
Но супероксиддисмутаза не единственный биологический фактор долголетия, обеспечивающий защиту генетического аппарата и других биоструктур от их повреждения активными формами кислорода и образуемыми при участии последних другими химически активными метаболитами. К числу таких факторов можно отнести каротиноиды. Если супероксиддисмутаза составляет одно из основных звеньев ферментативной защиты клетки от кислородного радикала, то среди неферментативных природных средств защиты от активных форм кислорода и вызванных ими реакций существенное значение имеют, вероятно, каротиноиды, особенно β-каротин. Такое заключение вытекает, в частности, из закономерности, которую наглядно демонстрирует рис. 10. На нем представлены результаты определения содержания каротиноидов в крови млекопитающих 16 видов, различающихся по видовой продолжительности жизни. Данные о содержании этих веществ были приведены в двух различных энциклопедических биохимических справочниках (разумеется, без указания зависимостей от продолжительности жизни).
На основании этих данных в 1983 году автор этой книги и обнаружил зависимость между продолжительностью жизни и содержанием каротиноидов в крови различных видов животных (кривые I и II). А в 1984 году американский биогеронтолог Р. Катлер с сотрудниками получил данные, подтверждающие эту зависимость (кривая III, рис. 10). Кроме того, в последние годы получило подтверждение предположение и об антиоксидантных свойствах каротина, и об его антиканцерогенной способности (подробнее об этом в следующей главе).
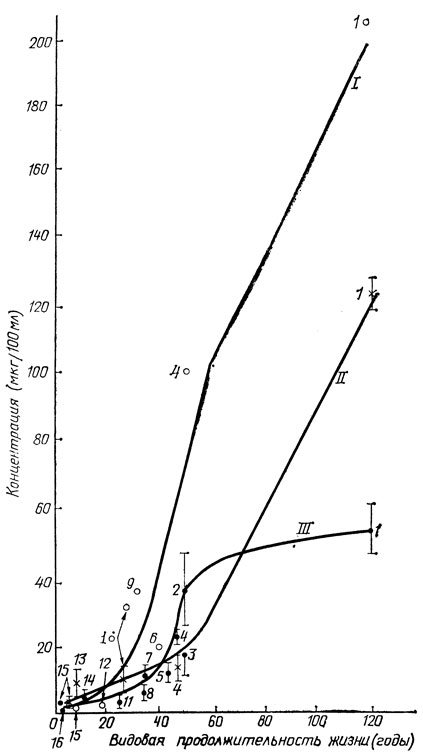
Рис. 10. Корреляция между содержанием β-каротина в крови млекопитающих различных видов и их продолжительностью жизни. Цифрами 1-16 обозначено содержание β-каротина у животных шестнадцати видов. Кривые I и II построены на основании данных о содержании β-каротина, приведенных (без определенной закономерности): I - в 'Биохимическом справочнике' (К. Лонг, Лондон, 1961); II - в справочнике 'Кровь и другие биологические жидкости' (П. Альтман, Д. Диттмер, Вашингтон, 1961). Кривая III - содержание β-каротина и ксантофилла из работы Р. Катлера (1984)
Кроме кратко рассмотренных здесь закономерностей, существуют и другие корреляции между тем или иным биохимическим, биофизическим или молекулярно-клеточным параметром - с видовой продолжительностью жизни организма, его устойчивостью к старению и, как правило, к раковым заболеваниям. Например, спонтанная нестабильность ДНК-клеток человека меньше, чем грызунов. Это заключение можно вывести, если оценивать нестабильность ДНК по таким разным критериям, как выделение с мочой гликолей тимина или тимидина (вероятно, продуктов окислительной деструкции ДНК - подробнее об этом сказано на с. 83 настоящей книги) или по частоте спонтанных мутаций в половых клетках в расчете на поколение (такая закономерность была сформулирована еще в первом издании этой книги).
Кроме того, обнаруживается прямая корреляция между видовой продолжительностью жизни млекопитающих и содержанием в их крови витамина Е (идея о его роли в поддержании жизнестойкости как основного природного антиоксиданта также была подробно обоснована в первом издании). Значение, конечно, имеет и иммунологическая система защиты. Существуют линии мышей, у которых в связи с наследственными изменениями иммунологической системы аутоиммунные реакции (выработка антител против антигенов, входящих в состав своих тканей) развиваются особенно активно. Часто продолжительность жизни таких животных в несколько раз меньше продолжительности жизни многих других линий мышей.
Известны также линии мышей с наследственным дефектом функций гипофиза и тимуса. Их продолжительность жизни также резко снижена. По данным выдающегося американского биогеронтолога Р. Л. Вэлфорда, у мышей, генетически отличающихся лишь по главному локусу гистосовместимости, наблюдаются значительные различия в продолжительности жизни. Поэтому Р. Л. Вэлфорд называет этот локус системой поддержания жизни.
Можно согласиться с таким заключением, особенно если учесть, что белки, синтезируемые под контролем локусов гистосовместимости (их называют Н-локусами), определяют не только комплекс иммунологических реакций при отторжении трансплантата (отсюда и название этой системы генов), но и устойчивость клеток и организма к вирусам и к физическим или химическим повреждающим факторам. Наверное, это обусловлено тем, что рассматриваемые гены контролируют также способность клеток к репарации ДНК. Таким образом, обобщая рассмотренные данные и учитывая, что биологические защитно-компенсаторные и приспособительные механизмы организма, их степень выраженности и особенно потенциальные способности генетически детерминированы, можно заключить: основное значение в долголетии имеют гены, контролирующие эти механизмы. Но такие гены - лишь ничтожная часть, как полагают многие генетики, примерно из 50 тыс. других генов, составляющих генотип человека. Кроме того, эффективность функции "генов долголетия" определяется условиями жизни организма.
Сказанное позволяет понять следующий факт. Изучение природы внутривидовой и внутрипопуляционной вариабельности по продолжительности жизни проводилось в различных лабораториях для оценки наследуемости продолжительности жизни. Однако полученные при этом результаты неоднозначны. Так, наследуемость продолжительности жизни у дрозофилы, по данным различных авторов, обычно колеблется от 0,08 до 0,194, у нематод - от 0,2 до 0,5, а у мышей - от 0,21 до 0,79. Советский генетик и биогеронтолог И. Г. Коган (Институт химической физики АН СССР), исследовавший наследуемость продолжительности жизни у дрозофил, показал, что она может быть больше обычно принятых величин, приведенных выше, и составлять 0,337.
Эти данные могут иметь общебиологическое значение, так как из них следует, что наследуемость продолжительности жизни, понимаемая в широком смысле, весьма велика, и, следовательно, гетерогенность в популяциях животных по продолжительности жизни может быть также большой.
Подобно тому как это наблюдается у других млекопитающих, продолжительность жизни человека - типичный полигенный признак. Но (опять же в согласии с закономерностями, которым подчиняются другие млекопитающие), анализируя влияние генов на долголетие человека, можно выделить главные гены с резким фенотипическим проявлением и дополнительные гены-модификаторы, действующие на количественные признаки. Следовательно, должны существовать белки - продукты главных и дополнительных "генов долголетия", которые в большей или меньшей степени составляют молекулярно-клеточную основу долголетия человека.
Ранее изложенные факты позволяют с большой вероятностью полагать, что к числу таких белков относятся: супероксиддисмутаза; система ферментов, участвующих в "точной" репарации ДНК; белки, "помогающие" такой репарации, например, посредством изменения конформации ДНК, облегчающей залечивание ее повреждений (или, другими словами, увеличивающие ее ремонтопригодность). К числу "генов долголетия" можно отнести также гены, определяющие высокую степень иммунокомпетентности (в частности, главный локус гистосовместимости, о котором речь уже шла), гены, контролирующие содержание в тканях природных антиоксидантов (в частности, гены, кодирующие белки, осуществляющие транспорт ретинола или β-каротина и таким образом, возможно, обеспечивающие высокий уровень β-каротина в плазме крови и в других тканях человека), и т. д.
А сейчас перейдем к краткому рассмотрению более прямых данных, касающихся долголетия человека, и постараемся понять биологические основы рассматриваемых феноменов.
Рут Дворская с сотрудниками из медицинского колледжа Калифорнийского университета исследовала иммунные реакции у практически здоровых людей четырех возрастных групп: 9-17, 17-40, 64-66 и 83-104 лет. В согласии с данными других авторов было обнаружено понижение с возрастом реакции лимфоцитов на некоторые стимуляторы их митотической активности. Среди неожиданных результатов были такие: в группе старых людей (83-104 года) был увеличен титр антител против ДНК - и среди них была резко увеличена доля людей с III (В) группой крови.
Эти данные примечательны тем, что они позволяют отметить два типа различий между "молодыми" и "старыми" популяциями людей. Первый тип включает приобретенные, истинно возрастные изменения (приведенные примеры нарушения функций лимфоцитов и, очевидно, изменения количества антител к ДНК). Второй связан с тем, что по мере вымирания популяции остаются индивиды относительно жизнестойкие. А если эта жизнестойкость коррелирует с тем или иным молекулярно-физиологическим параметром, то среди людей, доживших до преклонного возраста (средний возраст более 90 лет), этот параметр должен быть относительно более выраженным.
Приведенные результаты Рут Дворской с сотрудниками и данное им здесь объяснение можно связать со следующими, казалось бы, далекими от них фактами.
В 1976 году, рассказывая о том, каким образом смертность организмов зависит от возраста, я привел график, характеризующий эту зависимость для мышей (этот график воспроизведен на рис. 2). Я тогда обращал внимание читателя на тот вытекавший из графика факт, что когда мыши становятся старыми, их смертность может увеличиваться с возрастом менее круто.
Сегодня есть основания предположить, что такая же закономерность справедлива и для человеческих популяций - такие данные имеются для мужчин Швеции старше 103 лет (смертность с возрастом может даже уменьшаться).
Биологическая основа этой закономерности (если она подтвердится) может быть интерпретирована двояко. Во-первых, может существовать определенная группа людей, генетически очень устойчивых к старению (назовем их потенциальными долгожителями). В этом случае к 90 годам относительное число таких людей в общей популяции 90-летних людей становится значительным, а в следующие годы оно будет еще возрастать. Следовательно, говоря о смертности популяции, уже надо рассматривать не только компоненту, обусловленную старением популяции, но и ту, которая характеризует противоположный процесс - возрастание устойчивости популяции к старению вследствие увеличения в ней относительного числа потенциальных долгожителей.
Однако не исключено существование и другой биологической закономерности. У очень старых людей активируются защитные механизмы, препятствующие одряхлению организма и тем самым уменьшающие зависимость их смертности от дальнейшего увеличения возраста.
Но может быть, такая активация происходит в основном у потенциальных долгожителей, и тогда оба изложенных здесь предположения справедливы? Достоверных ответов на эти вопросы пока нет. Но напомню приведенные в III и IV главах факты, говорящие в пользу возможности индукции механизмов репарации ДНК (не исключено, что даже спонтанной индукции под влиянием спонтанных повреждений ДНК, "накопленных" со временем в очень старых клетках). Косвенное доказательство этому мы получили, исследуя спонтанный репаративный синтез ДНК в очень "старых" фибробластах человека, а также в нервных клетках старых крыс.
В связи с этим заманчиво напомнить, что автор в 1970 году в книге "Молекулярные механизмы старения" обосновал концепцию, суть которой в следующем. Увеличение числа набора хромосом (полиплоидизация) в клетках печени при старении может повышать устойчивость клеток к действию мутагенов и является компенсаторной реакцией в ответ на снижение генетического потенциала клеток, в частности в ответ на уменьшение числа рибосомальных генов.
В середине 70-х годов (И. Зутши, Б. Л. Каул - 1975, А. Шима, Т. Сугахара - 1976) было получено доказательство этой гипотезы. Интересные результаты при исследовании проблемы полиплоидизации хромосом были получены выдающимся советским цитологом В. Я. Бродским с его сотрудницей И. В. Урываевой (Институт биологии развития АН СССР). Сказанное еще раз свидетельствует: исследование механизмов старения и долголетия позволяет глубже понять биологические закономерности, особенно касающиеся защитных механизмов.
В 1918 году Г. Бэлл (США) опубликовал книгу, в которой на основании анализа продолжительности жизни 3000 человек показал: вероятность достижения возраста 80 и более лет у потомков долгожителей в 2-4 раза больше средней. А в конце 70-х годов стали известны данные (также опубликованные в США) о том, что люди, мать и отец которых были долгожителями, живут в среднем почти на десятилетие больше тех, у кого родители прожили 60 лет и меньше.
В последние годы исследования роли генетических факторов в долгожительстве в США были продолжены. В частности, М. Х. Кравфорд и Л. Рогерс в 1982 году закончили проводившиеся в течение ряда лет популяционно-генетические исследования лиц пожилого и старческого возраста, а также долгожителей одной из популяций, проживающей в Канзасе и Небраске. Была обнаружена "семейная корреляция" между продолжительностью жизни людей, находящихся в различных типах родственных связей. Но особенно сильной была корреляция между продолжительностью жизни матерей и дочерей (хотя М. Глассер приводит убедительные данные такой корреляции и при сравнении продолжительности жизни отцов и их сыновей).
Сегодня ведущее место в мире по исследованию долгожителей (ими у нас называют людей, достигших или перешагнувших 90-летний рубеж) занимают советские исследователи.
Популяцию долгожителей, проживающих в Абхазской АССР, начала исследовать уже в 30-е годы экспедиция под руководством президента Академии наук УССР академика А. А. Богомольца. Затем были исследованы и другие регионы и автономные подразделения Грузинской ССР: Юго-Осетинская автономная область (регион очень выраженного долгожительства) и Аджарская АССР. Но особенно подробно изучены абхазская и частично имеретинская популяции, проживающие в Западной Грузии.
Комплексная программа исследования феномена долгожительства осуществляется с 1978 года институтами геронтологии АМН СССР, экспериментальной морфологии АН ГССР, а также институтами психологии, фармакохимии и зоологии АН ГССР.
Долгожители в нашей стране имеются и в других республиках, причем во многих из них уровень долголетия, определенный по относительному числу людей в возрасте 80 лет и старше, за период с 1959 по 1970 год возрастал. Иллюстрацией этому служат данные, приводимые в таблице.
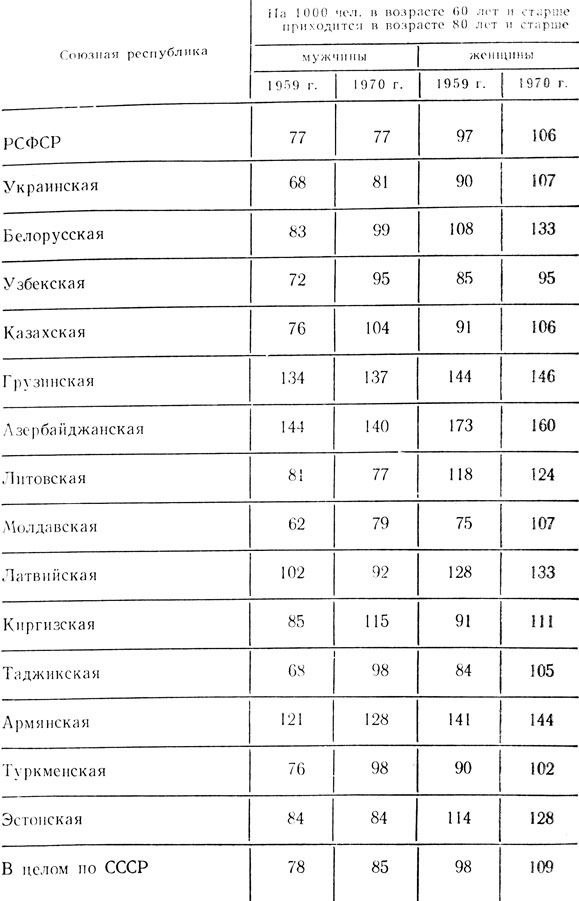
Уровень долголетия населения СССР в 1959 и 1970 гг. (Н. Н. Сачук, 1978)
Конечно, уровень долголетия определяется отнюдь не только генетическими, но и другими факторами, о которых речь пойдет в следующей главе. Но нас сейчас интересует возможность вычленить генетические факторы, чтобы определить биологические основы долголетия. В этом плане особый интерес представляют работы, в которых наряду с самими долгожителями изучаются и члены их семей. Так, предположение о генетической предопределенности продолжительности жизни подкреплено результатами эпидемиологических обследований, проведенных, в частности, советскими геронтологами Н. Б. Маньковским, А. Я. Минц, Р. П. Кузнецовой и С. М. Белоног в Киеве. Эти исследования показывают, что существуют семьи "со склонностью" к долголетию; но могут быть и такие семьи, продолжительность жизни членов которой, как правило, меньше средней.
Как отмечают известные советские геронтологи Г. М. Бутенко, В. П. Войтенко, Н. Б. Маньковский, А. Я. Минц и их соавторы, наиболее важной характеристикой потенциальных долгожителей является их относительная устойчивость к неблагоприятным факторам среды. Болгарский исследователь Г. Стойнев в своей книге "Изследования на столетниците в Българие" (София, 1972) пришел даже к парадоксальному заключению, что большинство из 426 обследованных им лиц преклонного возраста достигло его не благодаря, а вопреки условиям жизни, так как, например, 47% из обследованных были курящими. Эти данные отнюдь не умаляют роли благоприятных факторов для долгой жизни. Можно быть уверенными, что в наиболее благоприятных условиях (в частности, в случае отказа от курения) долгожители, обследованные Г. Стойневым, прожили бы еще больше. Но вот на что мы должны обратить внимание: из данных Г. Стойнева следует, что существуют генетические факторы, определяющие устойчивость организма и к одряхлению, и к неблагоприятным условиям (например, табачному дыму). И такие генетические факторы можно уже конкретизировать, основываясь, например, на данных о том, что при старении клеток и при действии на них табачного дыма в их ДНК индуцируются повреждения. И поэтому устойчивость и к Табачному дыму, и ко времени может определяться одними и теми же генами - контролирующими синтез белков, правильно залечивающих повреждения ДНК.
В конце 70-х годов профессор кафедры генетики Тбилисского университета Т. А. Лежава стал инициатором организации первого в мире международного симпозиума по цитогенетике старения. С тех пор состоялось еще два таких симпозиума. На первом симпозиуме большой интерес вызвали сообщения, из которых следует, во-первых, что в клетках людей-долгожителей, возможно, имеются определенные цитогенетические особенности (С. М. Кузнецова, Е. А. Черкасская) и, во-вторых, что долгожительство связано с увеличенной способностью к репарации ДНК (Г. Д. Бердыщев, А. Н. Хохлов и автор этих строк).
В согласии с этими результатами находятся и другие данные, например, американского генетика Л. Хенса с соавторами (1982) о том, что внутривидовые различия в продолжительности жизни определяются, в частности, соотношением эухроматина и гетерохроматина, количеством повторяющихся последовательностей ДНК и их изменением с возрастом. Но сходная концепция была сформулирована мною в 1970 году в книге "Молекулярные механизмы старения", а затем развита зарубежными авторами Р. Катлером, Б. Стрелером и другими.
Общим во всех этих концепциях является утверждение, что долголетие определяется числом дублированных генов (особенно рибосомальных генов), т. е. генетическим потенциалом, неуклонно истощаемым в процессе старения. Возможно, существует механизм компенсации такого истощения, но такой механизм включается далеко не во всех типах клеток, не у всех видов и, может быть, даже не у всех организмов одного вида, а только у потенциальных долгожителей.
В связи с ведущей ролью центральной нервной системы, в частности ее высших интегративно-координаторных центров, в защитных (адаптационно-приспособительных) реакциях организма и в механизмах старения большой интерес представляют результаты исследования группы отечественных ученых (Н. Б. Маньковский и А. Я. Минц с соавторами из Института геронтологии АМН СССР) функциональных особенностей и особенностей кинетики возрастных изменений ЦНС у долгожителей и членов их семей. Такое исследование проводили с помощью одного из самых совершенных методов анализа активности головного мозга - определением его биоэлектрической активности (электроэнцефалограммы - ЭЭГ) с помощью многоканальных энцефалографов. Среди наиболее интересных результатов генеалогического анализа - данные о том, что в семьях долгожителей нередко обнаруживается определенная частота α-ритма. Например, на фоновых ЭЭГ α-активность с частотой 10-10,5; 11-11,5 в семьях долгожителей зарегистрирована в 65-80%, а в контрольных популяциях людей - 20-35%.
Широкие и глубокие исследования долгожительских популяций в разных этнических группах Грузинской ССР проводятся в Институте экспериментальной морфологии им. А. Н. Натишвили в Тбилиси. В частности, С. М. Далакишвили, Н. Г. Лелашвили, Ш. Д. Гогохия изучили абхазскую и имеретинскую популяции по комплексной программе. Данные, полученные ими, показали, что различные физиологические системы стареют не по линейному закону. В пределах среднего и старческого возраста существуют возрасты повышенного риска нарушения гомеостаза. Возможно, в эти периоды увеличивается нестабильность генома, или накопленные ранее повреждения ДНК и другие молекулярно-клеточные нарушения "реализуются" в физиологические.
К числу наиболее сильных доказательств взаимосвязи между предрасположенностью к тяжелым хроническим болезням и старением или устойчивостью к этим болезням и долголетием относятся результаты наблюдения за долгожителями и членами их семей. Так, у долгожителей почти отсутствует артериальная гипертензия. А чехословацкий геронтолог Б. Здишнек в 1978 году показал, что у долгожителей его страны уменьшена "семейная" частота сосудистых заболеваний. Кроме того, Хо-Джи-Чен в 1982 году и С. Глюек с соавторами в 1976 году соответственно в Китае и Финляндии обнаружили интересные особенности липидного обмена в семьях долгожителей. Среди долгожителей сердечнососудистые заболевания если и развиваются, то протекают с незначительно выраженными клиническими проявлениями. Даже у родственников долгожителей В. П. Войтенко (Институт геронтологии АМН СССР) обнаружил "смягчение" характера и клинического течения сердечно-сосудистой патологии. Есть основания полагать, что у долгожителей относительно больше, чем в среднем у остальных людей, устойчивость к атеросклерозу, аутоиммунным заболеваниям и к раку.
О. Гзелл в 1981 году (Швейцария) провел генеалогический анализ семейного долголетия одной семьи, предки которой проживают в Швейцарии на протяжении по крайней мере 200 лет. Он также пришел к заключению, что семейное долголетие сочетается с устойчивостью к сердечно-сосудистым и некоторым другим хроническим заболеваниям дегенеративного характера (ожирение и другие болезни с нарушением обмена).
Если принять во внимание роль перекисей липидов в развитии атеросклероза, то данные М. Сузуки с соавторами (Япония), полученные ими в 1981 году, позволяют приблизиться к пониманию молекулярной основы связи между долгожительством человека и его устойчивостью к сердечнососудистым заболеваниям. Авторы провели комплексное биохимико-медико-социологическое обследование 80 людей старше 100 лет. У исследованных долгожителей обнаружены не только устойчивость сердечно-сосудистой системы к старению и заболеваниям, но и относительно низкое содержание в сыворотке перекисей липидов; при этом увеличено содержание свободных аминокислот. Но известно, что по крайней мере некоторые из них могут перехватывать свободные радикалы и обезвреживать их. Таким образом, относительно низкая интенсивность повреждения тканей свободными радикалами и относительно высокая степень молекулярной защиты от этих радикалов - вот одна из вероятных причин долгожительства человека.
В первом издании книги содержалось утверждение: человек подчиняется общему биологическому закону, гласящему, что женские организмы живут дольше, чем мужские. Результаты исследований, проведенных в последние годы, подкрепляют цитированное положение. Особенно интересны данные по нашей стране, опубликованные в 1978 году Н. Н. Сачуком. Они приведены в табл. 1 и показывают, что уровень долголетия среди женщин в нашей стране значительно больше, чем среди мужчин.
Среди животных организмов многих видов женские особи живут дольше мужских. Это косвенно свидетельствует в пользу предположения о существовании генетических факторов долголетия. Но что же это за гены?
В общей форме ответ может быть однозначным. Это гены, локализуемые в X-хромосоме. Ведь генотип мужчины отличается от генотипа женщины тем, что в его клетках содержится пара хромосом XY, в то время как в генотипе женщины - XX. Но значение могут иметь и другие особенности организации "женского" генома (С. М. Кузнецова, 1978).
|
ПОИСК:
|
© GELIB.RU, 2013-2019
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'