
Гистоны
Гистоны - белки с малой молекулярной массой - обнаружены в хроматине всех эукариотов. Их впервые открыли в 1943 г. Стедман и Стедман [330]. Эти белки имеют основной характер и положительно заряжены при физиологических значениях рН, поскольку они богаты лизиновыми и аргининовыми остатками. Они не содержат триптофана и присутствуют в клетках в отношении 1:1 с ДНК. Имеется пять основных типов гистонов: Н1, H2A, H2B, Н3 и Н4, которые различаются по величине соотношения лизина и аргинина. Их легко разделить с помощью электрофореза в полиакриламидном геле (рис. 2.1). Некоторые характеристики гистонов из тимуса теленка приведены в табл. 2.1.
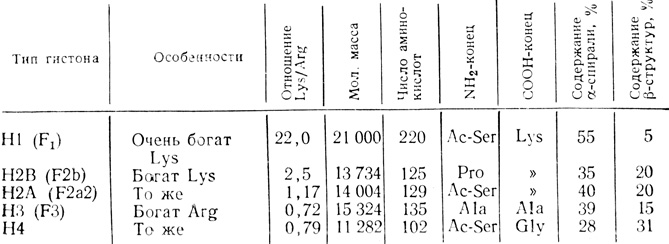
Таблица 2.1. Параметры гистонов из тимуса теленка
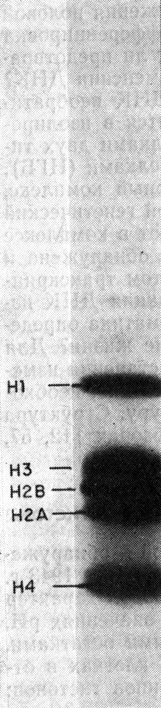
Рис. 2.1. Электрофореграмма гистонов в полиакриламидном геле
Важное свойство всех гистонов состоит в том, что их положительно заряженные лизиновые и аргининовые остатки образуют кластеры в особых областях полипептидной цепи. Этим и объясняется наличие во вторичной структуре гистонов вытянутых β-структур. Очевидно, эти положительно заряженные β-структуры связываются с отрицательно заряженными фосфатными группами ДНК сильнее, чем с другими группами. Нейтрализация положительных зарядов в гистонах должна приводить к их отделению от ДНК. Из табл. 2.1 видно, что гистоны H2A, H2B, Н3 и Н4, находящиеся внутри нуклеосом, имеют больше вытянутых β-структур, чем гистон Н1, расположенный между нуклеосомами.
Прокариоты не имеют гистонов. Появление гистонов совпало с возникновением ясно выраженных ядер, хромосом и процесса дифференцировки. Гистоны подавляют синтез РНК [167] и ДНК [142] in vitro. При полном или частичном удалении гистонов из хроматина сильно увеличивается его матричная активность. Однако маловероятно, чтобы гистоны контролировали или регулировали транскрипцию генов, так как: а) имеется только пять основных видов гистонов, тогда как геном эукариотов содержит несколько тысяч генов; б) количество гистонов обычно постоянно в клетках всех типов и во всех периодах жизни; в) количество гистонов одинаково в метаболически активных и метаболически неактивных клетках. Следовательно, можно предположить, что гистоны включены в структуру и организацию хроматина и действуют как общие репрессоры его активности.
Гистон Н1
Гистон Н1 очень богат лизином - около 25% входящих в его состав аминокислотных остатков составляет лизин. Он отделяется от ДНК гораздо легче других гистонов. Этому гистону свойствен полиморфизм, т. е. в одной ткани может быть несколько видов гистона Н1 с различными последовательностями аминокислот. В тимусе и печени крыс обнаружены пять изогистонов Н1. Относительное содержание изогистонов Н1 в разных тканях одного и того же организма различно [58, 114, 189, 190] и изменяется в течение клеточного цикла [160]. Показано, что различные подфракции гистона Н1 морского ежа синтезируются на разных стадиях развития яйца. В некоторых яйцах одна фракция гистона Н1 заменяется на другую во время перехода от бластулы к гаструле; в других это изменение происходит во время вылупления. Разные фракции гистона Н1 из тимуса кролика дают различные спектры кругового дихроизма с ДНК фага Т7 [370]. Отсюда следует, что различные подфракции гистона Н1 имеют различные функции [8, 307].
При изучении последовательности аминокислот подфракций гистона Н1 было показано, что в отличие от остальных четырех гистонов он имеет основной концевой COOH-участок. Концевая NH2-область (1-40) также имеет основной характер (24-39). В концевой NH2-области изогистонов Н1 найдено большое число аминокислотных замен. Эти замены, по-видимому, определяют функциональные различия изогистонов Н1 во взаимодействии с НГБ и эффекторами, а также в связывании с ДНК. Концевая NH2-область представляет собой неупорядоченную спираль. Центральный участок [(39±4)-(116±4)] кроме большого числа аминокислот кислотного характера и двух ароматических аминокислот содержит неполярные аминокислоты. Этот участок способен к образованию вторичной глобулярной структуры. Он в основном инвариантен и весьма консервативен, т. е. все гистоны Н1 различных организмов имеют в этой области практически одну и ту же последовательность аминокислот. По-видимому, она играет существенную роль в структуре хроматина.
Концевая COOH-область является сильно основной из-за наличия большого числа лизиновых остатков и весьма консервативна внутри одного вида. Поэтому она может играть общую роль во всех гистонах Н1. Она также представляет собой неупорядоченную спираль. Эта область в основном ответственна за связывание с ДНК. Предполагают, что основные области гистона Н1 связываются с ДНК, а неполярная и глобулярная центральная область взаимодействует с другими молекулами [77, 89, 154]. Стафилококковая дезоксирибонуклеаза специфически расщепляет хроматин между нуклеосомами, в результате чего образуются фрагменты ДНК, связывающие две соседние нуклеосомы. Показано, что гистон Н1 соединяется приблизительно с 30-60 парами оснований этих фрагментов ДНК, т. е., по-видимому, гистон Н1 не участвует в образовании структуры нуклеосомы, а располагается в областях между нуклеосомами. Положительный заряд гистона Н1 выше, чем у других гистонов. Он первым вытесняется из хроматина кислотой или щелочью и в большей степени подвержен разрушению протеазами, когда еще находится в связанном состоянии в комплексе хроматина [26, 263]. Если гистон Н1 добавить к хроматину с недостаточным содержанием этого гистона, то хроматин сжимается [46, 47]. Если же гистон Н1 смешать с двухцепочечной ДНК, то образуются структуры, имеющие форму бублика (тора) [166]; другие гистоны в подобных условиях участвуют в образовании глобул, похожих на нуклеосомы. Таким образом, гистон Н1, вероятно, участвует в образовании структур хроматина высшего порядка, а именно способствует закручиванию нитей нуклеосом в сверхспиральный виток с диаметром ~20 нм [47]. Аналогичные структуры образует с ДНК гистон Н5. Вероятно, различные подфракции гистона Н1 могут быть связаны с различными межнуклеосомными (линкерными) областями хроматина и участвуют в образовании разных сверхспиралей. В интерфазном хроматине ДНК свернута в несколько тысяч раз, благодаря чему она умещается по длине метафазной хромосомы. Определенную роль в этой конденсации ДНК может играть гистон Н1.
Гистон Н1 отличается от остальных гистонов быстрым обменом в культуре клеток [16]. В то время как синтез остальных четырех гистонов связан с синтезом ДНК и происходит только в S-фазе, синтез Н1 в клетках штаммов Friend и HeLa может происходить и в отсутствие синтеза ДНК, т. е. в G1-фазе [385]. В клетках ВНК синтез гистона Н1 также частично происходит в G1-фазе,[343].

Таблица 2.2. Сравнение свойств гистона Н1 и нуклеосомных гистонов
Гистоны Н2А, Н2В, Н3 и Н4
В процессе расщепления хроматина стафилококковой дезоксирибонуклеазой образуются глобулярные структуры, называемые нуклеосомами. Анализ нуклеосом показывает, что четыре гистона - Н2А, Н2В, Н3 и Н4 - присутствуют только в них. В ходе эволюции их структуры оказались гораздо более консервативными, чем структура гистона Н1, причем структуры гистонов Н3 и Н4 более консервативны, чем структуры гистонов Н2А и Н2В. Гистон Н3 содержит цистеин в положении 110, который сохранялся в течение всей эволюции. Показано, что гистон Н3 димеризуется путем образования дисульфидного мостика [280]. Он фосфорилируется при переходе из G2-фазы в М-фазу и быстро дефосфорилируется в течение фазы G1. Таким образом, фосфорилирование предшествует образованию дисульфидного мостика.
Очищенные гистоны Н3 и Н4 образуют в растворе тетрамеры, в формировании которых принимают участие концевые COOH-участки цепи. В опытах по реконструкции с использованием частично расщепленных гистонов Н3 и Н4 показано, что первые от NH2-конца 41 и 37 остатков гистона Н3 и гистона Н4 соответственно несущественны для образования тетрамеров. Удаление 45 и 18 остатков с COOH-конца этих гистонов препятствует образованию тетрамеров. Областями, ответственными за образование тетрамеров, являются остатки 42-120 гистона Н3 и 38-102 гистона Н4 [43, 371]. Что касается гистона Н2В, то его центральная область, по-видимому, необходима для взаимодействия гистон - гистон [197].
Гистон Н5
Кроме гистонов пяти типов, которые присутствуют во всех клетках и тканях, имеющие ядро эритроциты низших позвоночных, рыб, амфибий, рептилий и птиц содержат другой гистон, Н5, который во многом похож на гистон Н1. Он был впервые обнаружен в эритроцитах цыпленка в 1961 г. [266], и позднее его существование было подтверждено [159]. Гистон Н5 содержит приблизительно 197 аминокислотных остатков, дает полосу рядом с гистоном Н1 при электрофорезе в полиакриламидном геле и имеет молекулярную массу ~23000. Ему свойствен молекулярный полиморфизм, а расположен он между нуклеосомами. Гистон Н5 связан с А-Т-областью ДНК и, так же как гистон Н1, оказывает стабилизирующее влияние на хроматин. Он тоже богат лизином, который составляет 23% его аминокислотных остатков. С помощью метода ЯМР установлено, однако, что он отличается от гистона Н1, и, возможно, его эволюция происходила самостоятельно [78]. Лизиновые остатки гистона Н5 ацетилированы в большей степени, чем у гистона Н1, но не так сильно фосфорилированы. Он содержит большое число сериновых остатков (21), и у него, в отличие от гистона Н1, не наблюдается специфического образования кластеров из основных аминокислот на NH2-конце. В противоположность гистону Н1 его NH2-конец имеет структуру глобулы.
Информационная РНК (мРНК) гистона Н5 не содержит полиадениловой кислоты на 3′-конце, как это имеет место в случае других гистонов. У птиц на ранних стадиях развития клеток эритроидного ряда содержится мало гистона Н5. По мере развития этих клеток его количество увеличивается и, как следствие, уменьшается транскрипционная активность хроматина, хотя содержание РНК - нуклеотидилтрансферазы не меняется. В неделящихся зрелых эритроцитах синтез гистона Н5 продолжается даже тогда, когда другие пять гистонов уже не синтезируются [336]. Если гистон Н5 удалить из хроматина, то подавление транскрипционной активности ослабляется. Его синтез не координирован с синтезом других гистонов и не синхронизирован с синтезом ДНК: он синтезируется после других гистонов. Поскольку на ранних стадиях развития эритроцитов гистон Н5 отсутствует и появляется только на стадии эритробласта, когда он постепенно накапливается и подавляет при этом транскрипционную активность, было высказано предположение, что подавление происходит в результате конденсации хроматина, ведущей к его инактивации. Если ввести гистон Н5 не в эритроциты, а в другие клетки, то транскрипция также подавляется. Другое важное обстоятельство заключается в том, что вновь синтезированный гистон Н5 в развивающихся клетках эритроидного ряда фосфорилирован, а впоследствии, в ходе созревания клеток и ослабления транскрипции, дефосфорилируется. Таким образом, гистон Н5 играет, по-видимому, важную роль в поддержании сильно репрессированного состояния хроматина в имеющих ядра эритроцитах [35, 49, 168, 336]. Интересно отметить, что экспрессия гена гистона Н5 происходит только в клетках эритроидного ряда на специфической стадии, но как начинается его экспрессия и как она запрограммирована - неизвестно.
Протамины
Протамины представляют собой основные белки с малой молекулярной массой; они присутствуют в хроматине спермы вместо гистонов. Протамины появляются на стадии сперматиды и заменяют гистоны хроматина. Для них характерен полиморфизм. В сперме форели содержатся протамины трех типов, состоящие из 31-33 аминокислот. Протамины спермы млекопитающих длиннее - в их цепях ~45 аминокислот. Они богаты аргинином и не содержат лизина и триптофана; аргинин составляет две трети всех аминокислот. Собирающиеся в кластеры аргининовые остатки образуют длинные участки, с помощью которых протамины связываются с ДНК сперматид. После образования этой связи транскрипционная активность хроматина полностью подавляется. Если удалить протамины, то хроматин принимает вид бусинок и становится чувствительным к микрококковой нуклеазе. При добавлении протаминов эта структура исчезает и хроматин становится невосприимчивым к нуклеазе. Сериновые остатки протаминов могут быть фосфорилированы и дефосфорилированы. Полагают, что эта ковалентная модификация необходима для правильного связывания протаминов с ДНК [105], Ниже показана структура типичного протамина рыб:
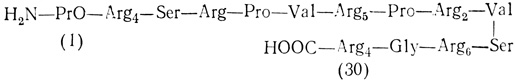
Протамины, как и гистоны, синтезируются в цитоплазме. Их короткие мРНК транслируются на дирибосомах. Эти РНК в отличие от мРНК гистонов содержат на 3′-конце полиадениловую кислоту [169]. На 5′-конце они имеют 7-метилгуанин. Хотя в семенниках форели протамины синтезируются на стадии сперматиды, транскрипция их мРНК происходит значительно раньше, а именно на стадии первичного сперматоцита [170]. мРНК так же, как и рибонуклеопротеидные частицы, до наступления стадии сперматиды остается неактивной. Аналогичная ситуация наблюдается и в случае гистонов. Ооциты Xenopus содержат мРНК материнских гистонов в неактивной форме, которые активируются и транслируются во время деления яйца. Протамины содержатся только в сперматоцитах, однако неизвестно, почему экспрессия их генов происходит только в этих клетках и как она начинается на соответствующей стадии развития этих клеток.
Гены гистонов
Гистоны синтезируются в S-фазе клеточного цикла. Это обстоятельство помогло выделить мРНК гистонов из быстро делящихся эмбрионов для идентификации и локализации генов гистонов путем молекулярной гибридизации и клонирования [39, 51, 187, 373]. На ранней стадии дробления эмбриона морского ежа гистоны составляют 25-30% вновь синтезируемых белков, а мРНК гистонов - почти 70% всех мРНК. Кроме того, мРНК гистонов гибридизуются с ДНК в несколько сотен раз быстрее, чем многие другие мРНК. Это указывает на наличие большого числа копий генов гистонов. При исследовании шести видов морских ежей было показано, что гены гистонов повторяются в гаплоидном геноме 300-1000 раз. У Drosophila, Xenopus, человека и цыплят повторяемость составляет 100, 10-20, 10-20 и 10 раз соответственно. Такие большие различия в количестве этих генов могут быть связаны с тем, что гистоны необходимы на ранней стадии дробления. Яйца Xenopus содержат большое количество материнских гистонов, тогда как в яйцах морского ежа их очень мало. По-видимому, в первом случае у клеток нет необходимости синтезировать на ранней стадии быстрого деления большое число гистонов. Во втором случае нужно быстро синтезировать гистоны, чтобы не отставать от темпа быстрого деления клеток, и большое количество генов способствует этому.
В исследованиях на Drosophila показано, что гены гистонов расположены в хромосоме II. Пять структурных генов пяти гистонов богаты парами G-C и тандемно повторяются. Они разделены участками, богатыми парами А-Т, которые не транслируются. Вся область кодирования генов гистона содержит 6000-7000 пар оснований ДНК. Ниже показаны расположение и длина генов в яйце морского ежа вместе со спейсерными участками (S) [39].

Структурные гены гистонов не содержат интронов, или нетранслируемых областей, как гены глобина, яичного альбумина и иммуноглобулина, а также не транскрибируются как более длинные предшественники РНК [312]. Спейсерные области не имеют небольших повторяющихся последовательностей оснований, как это наблюдается у генов рРНК и 5S-PHK. У всех видов морских ежей порядок расположения и направления транскрипции гистоновых генов одинаковы, тогда как у разных видов Drosophila они различны [230]:
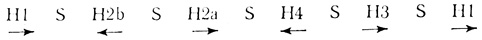
Синтез и обновление гистонов
Гены гистонов транскрибируются в направлении 5′→3′ с помощью РНК-полимеразы II, так как процесс транскрипции чувствителен к α-аманитину [225]. По-видимому, мРНК пяти гистонов транскрибируются отдельно, а не как единая полицистронная мРНК [205]. Они имеют коэффициент седиментации приблизительно 9S и могут быть разделены в полиакриламидном геле [187]. На 3′-конце мРНК гистонов нет полиадениловой кислоты [5], а на их 5′-конце присутствуют последовательности m7G(5′)pppNm или m7G(5′)pppNmpN [260].
Синтез гистонов тесно связан с синтезом ДНК. мРНК гистонов синтезируются в начале S-фазы, а затем переходят в цитоплазму, где они соединяются с рибосомами для синтеза гистонов [293, 303, 310, 331]. мРНК гистонов существуют приблизительно столько же времени, сколько длится S-период, т. е. 10-12 ч. Есть сообщение, что для транскрипции мРНК гистонов необходимы фосфорилированные НГБ [194], но оно требует подтверждения.
Если синтез ДНК затормозить с помощью цитозинарабинозида или оксимочевины, то синтез мРНК гистонов также прекращается, уже образовавшиеся мРНК разрушаются и синтез гистонов останавливается. Как только это происходит, прекращается также синтез ДНК [188, 366, 379]. Таким образом, клетка обладает механизмом, "включающим" и "выключающим" гены гистонов в соответствии с синтезом ДНК. Стехиометрическое соотношение синтезированных гистонов Н1:Н2А:Н2В:Н3:Н4 равно 0,5:1:1:1:1. Это свидетельствует о том, что четыре гена нуклеосомных гистонов транскрипционно связаны, и их трансскрипция, вероятно, скоординирована. По-видимому, матрица для гистона Н1 не связана с другими генами, поскольку количество синтезированного гистона Н1 составляет только половину количества других гистонов. У Drosophila, расположение гистоновых генов у которой отличается от расположения генов у морского ежа, ген гистона Н1 отделен от гена гистона Н3 1200 парами оснований ДНК. Следовательно, он может иметь самостоятельный промотор [230]. Более того, синтез гистона Н1 в фазе G1 в три раза интенсивнее синтеза других гистонов [343].
Известно несколько исключений из общего правила сопряжения синтеза гистонов с синтезом ДНК. Например, у лягушки Xenopus laevis при эмбриогенезе не наблюдается упомянутой синхронности на ранних стадиях дробления [3]. В зародышах Vicia faba гистоны появляются в фазах G1 и S [123]. На ранних стадиях эмбриогенеза морского ежа синтез гистонов начинается в фазе G1 и продолжается до фазы G2. Однако в начале дифференцировки их синтез становится синхронным с синтезом ДНК [17]. Обусловлена ли эта синхронизация каким-либо фактором, появляющимся на стадии дифференцировки, неизвестно. В клетках HeLa мРНК гистонов транскрибируется в течение всего клеточного цикла, но их трансляция происходит только в S-фазе [250]. Таким образом, в клетках HeLa с синтезом ДНК координирована трансляция, а не транскрипция. Очевидно, синтез гистонов регулируется на двух этапах - трансляции и транскрипции - с помощью двух разных сигналов. Поскольку молекулы мРНК гистонов малы, их трансляция происходит на дирибосомах. После синтеза гистоны переходят из цитоплазмы в ядро [366].
Судьба четырех нуклеосомных гистонов в процессе деления клетки изучалась с помощью 3Н-лизина и других меченых аминокислот [220]. На примере культуры in vitro миобластов цыпленка показано, что, когда клетка делится, уже существовавшие нуклеосомные гистоны остаются в одной из дочерних клеток, а вновь синтезированные гистоны переходят в другую клетку. Таким образом, новые гистоны, по-видимому, не смешиваются со старыми, и какое-то время их состав сохраняется неизменным. Последовательно синтезирующиеся нуклеосомы располагаются в основном рядом друг с другом. Более того, гистоны в них существуют в неизменном виде в течение трех-четырех поколений. Каким образом это достигается, неизвестно. По-видимому, существует механизм, с помощью которого дифференцированное состояние материнской клетки может передаваться дочерним. В работе с использованием 3Н-аргинина и 125I-иоддезоксиуридина в культуральной среде, содержащей клетки мыши [153], было показано, что нуклеосомные гистоны сохраняются в течение многих поколений. Этот факт очень важен, так как ново-синтезированные гистоны связаны с новообразованной ДНК [353]. Высказано предположение, что некоторые НГБ также сохраняются в процессе деления клетки [122]. Такая консервация нуклеосом и НГБ вместе с последующей транскрипционной специфичностью может служить тем механизмом, с помощью которого достигается и сохраняется дифференцировка клетки. Гистон Н1, однако, в течение одного клеточного поколения обновляется на 15% [141]. Кроме того, он интенсивно фосфорилируется в конце фазы G2 клеточного цикла, что совпадает по времени с конденсацией хромосомы [48]. Быть может, фосфорилирование является пусковым механизмом митоза.
|
ПОИСК:
|
© GELIB.RU, 2013-2019
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'