
Накопление в ДНК клеток человека повреждений первичной структуры
Теперь я расскажу подробнее о результатах исследований, проведенных нами на культивируемых клетках человека. Повреждения ДНК клеток человека были исследованы при старении этих клеток в организме (in vivo), а также вне организма (in vitro). Кроме того, такие повреждения ДНК были сопоставлены с повреждениями ДНК, возникающими при не очень интенсивном прогревании клеток или облучении их ионизирующим излучением. Рассказывая о наших данных, я познакомлю любознательного читателя с некоторыми особенностями изучения повреждений ДНК "щадящим" методом.
Один из основных методов анализа ДНК, использованных нами при исследовании этих вопросов, - метод седиментации ДНК в градиенте щелочной сахарозы. Этот метод уже упоминался (см. с. 27). Мы сразу перейдем к рассмотрению полученных вместе с А. Н. Хохловым данных, делая пояснения методики при изложении результатов.
На рис. 8 представлены седиментограммы ДНК эмбриональных фибробластов и фибробластов, полученных из кожи 91-летнего донора. На графике указано, какой процент ДНК от общей массы ДНК (содержавшейся в клетках, нанесенных на градиент) был в той или иной из фракций (частей), на которые разделяли содержимое центрифужной пробирки после окончания центрифугирования. 1-я фракция соответствовала дну пробирки, 15-я - верху градиента. Это означает, что высокомолекулярные фракции ДНК - первые, низкомолекулярные - последние номера фракций. И следовательно, чем больше седиментограмма сдвинута вправо, тем меньше среднее значение молекулярной массы ДНК, тем больше в ней было разрывов.
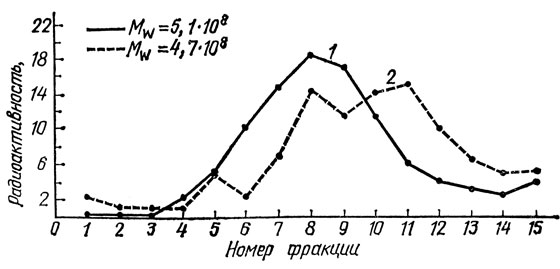
Рис. 8. Профили седиментации ДНК диплоидных фибробластов медицинского абортуса (1) и фибробластов кожи 91-летней женщины (2). Цифры на рисунке - средние значения молекулярных масс ДНК соответствующих клеток
На графике приведены также значения средневесовых молекулярных масс, рассчитанных с помощью ДНК фага λb2. Молекулярная масса этой ДНК известна, а положение ее в градиенте, использованном при исследовании клеток человека, позволяло рассчитать массу их ДНК.
Очевидно, нелишней будет такая подробность. Штаммы эмбриональных фибробластов были получены из Института медицинской генетики АМН СССР. Предварительно они были исследованы там К. Н. Гринбергом, и хромосомных изменений в них не было найдено, т. е. это были нормальные клетки, хотя получены они были из тканей при аборте. Культуры "взрослых" и "старых" фибробластов получены безболезненным и безвредным методом биопсии с передней поверхности кожи предплечья здоровых доноров, пожелавших, чтобы их клетки были обследованы. (Здесь я опять должен с благодарностью вспомнить о большой помощи со стороны К. Н. Гринберга и Г. Д. Бердышева.) Клетки кожи 91-летней женщины к нам попали из Института геронтологии АМН СССР (Киев), где эта пациентка находилась на обследовании (и у нее не было найдено резких патологических изменений).
Опыты с клетками каждого человека нужно было повторять многократно, поэтому приходилось все культуры пересевать. Исследовались культуры, которые еще не вступили в фазу дегенерации (вспомним, что эмбриональные диплоидные фибробласты человека совершают в культуре клеток около 50 делений, взрослые фибробласты даже меньше).
Для устранения осложнений, связанных с возможным образованием разрывов в фазе репликации ДНК, использовали только культуры клеток, находящиеся в состоянии сомкнутого монослоя, когда вследствие контактного торможения митотическая активность клеток прекращалась. Кроме того, чтобы исключить образование в ДНК таких разрывов, за 24 часа до снятия клеток со стекла среду их роста заменяли на свежую, не содержащую меченого тимидина. Далее клетки наслаивали на 5-20%-ный градиент сахарозы, содержащий также другие вещества в определенных количествах, специально подобранные, чтобы избежать артефактов при центрифугировании ДНК.
Как видно из рис. 8, седиментограмма ДНК "старых" фибробластов сдвинута вправо по сравнению с седиментограммой ДНК эмбриональных фибробластов, а среднее значение массы первой меньше массы второй. Эти результаты можно с большой вероятностью интерпретировать как доказательство накопления с возрастом в ДНК однонитевых разрывов и щелочелабильных связей (апуриновых участков, алкилированных фосфатных групп и т. д.).
Изменения ДНК в клетках, полученных от старых людей, а также в клетках культур последних пассажей не были для нас неожиданными. Однако теоретически непредсказуемый результат был получен при сравнении ДНК диплоидных фибробластов эмбрионального происхождения и ДНК фибробластов, полученных из кожи молодых здоровых доноров (в возрасте 25-30 лет).
Эти данные позволяют утверждать, что в клетках ДНК человека начинается накопление щелочелабильных связей, когда организм еще молод. Особенностью диплоидных фибробластов является то, что их митотический потенциал уменьшается начиная с периода эмбрионального развития. И если такое уменьшение принять за общий критерий старения клеток, то получается, что диплоидные фибробласты начинают "стареть", вероятно, еще до того, как закончился период эмбрионального развития организма. Возможно, тогда же начинается и накопление спонтанно возникающих повреждений ДНК.
В 1984 году группа французских ученых из Института исследований рака (А. Мациейра-Коэлхо с сотрудниками) подтвердила наши (А. Н. Хохлова и автора этих строк) данные, опубликованные в 1978 году. Речь идет о появлении низкомолекулярной ДНК в культурах фибробластов человека, если эти фибробласты исчерпали свой митотический потенциал (т. е. исследовали культуры, находившиеся на последних пассажах). Как и мы, французские коллеги исключили возможность образования такой ДНК в процессе лизиса клеток (вследствие действия на ДНК щелочи, детергента или клеточных ферментов). Они также обнаружили существенные изменения хроматина у "старых" фибробластов. Но что особенно интересно, если клетки в течение длительного времени обрабатывали гидрокортизоном, то по крайней мере у ядрышка старение структуры хроматина значительно задерживалось. Это может быть молекулярным механизмом задержки старения, поскольку уже относительно давно известно, что под влиянием гидрокортизона митотический потенциал фибробластов, продолжительность жизни их культур in vitro существенно возрастают.
Недавно для исследования тонких изменений структуры хроматина в фибробластах человека использовали специальный анализатор его изображений, полученных на электронных микрофотографиях с помощью телевизионного сканирующего устройства. Таким образом, можно было судить о плотности нитей хроматина, их длине и ширине. Группа того же крупнейшего в мире специалиста по культивированию клеток и их старению in vitro А. Мациейра-Коэлхо, проводившая эти исследования, пришла к заключению, что наблюденные ими изменения хроматина отражают деградацию ДНК в процессе старения клеток in vitro, т. е. согласуются с изменениями ДНК, которые мы, а затем они (а также ученые в США и Японии) наблюдали с помощью методов центрифугирования и других физико-химических методов.
Данные зарубежных исследователей находятся в согласии и с другими нашими данными - о накоплении повреждений ДНК при старении клеток в организме. Правда, изучались не полностью идентичные клетки. Мы исследовали фибробласты, взятые из тканей эмбрионов-абортусов и из кожи здоровых взрослых людей различного возраста; группа А. Мациейра-Коэлхо исследовала клетки доноров разного возраста, хранившиеся в замороженном состоянии в клеточном банке Национального института старения США. Авторы обнаружили прямую корреляцию между возрастом людей - доноров исследованных клеток и выраженностью изменений хроматина в этих клетках (которые, как отмечалось, они рассматривают как показатель деструкции ДНК).
Мы подробно говорим о возрастных изменениях ДНК, поскольку они имеют существенное значение не только для понимания молекулярных механизмов старения, но и важны практически.
Правда, пока использовать эти данные на практике не удается, это дело будущего, хотя значимость их становится все более очевидной в связи с теперь уже актуальной и в онкологии, и в гигиене проблемой индивидуальной чувствительности людей к канцерогенным агентам, загрязняющим окружающую среду. Кстати, все сказанное здесь может служить и доказательством взаимосвязи молекулярно-клеточных аспектов проблем биологии долголетия и экологии.
Как подчеркивается в аннотации к книге известного советского ученого Г. Н. Кассиля "Внутренняя среда организма" (М., Наука, 1978, 1983), одна из ведущих проблем современной биологии - учение о гомеостазе или динамическом постоянстве внутренней среды и основных физиологических функций организма генома и животных. В советской физиологии и геронтологии сложилась прочная и плодотворная традиция рассматривать старение как нарушение гомеостаза. Автор старался продолжить и развить эту традицию, распространив понятие гомеостаза и на молекулярно-клеточный уровень. При таком подходе обнаруживается, что даже ДНК является лишь динамически постоянной структурой, а поддерживаемое в клетке равновесие (динамическое) между возникновением повреждений ДНК и их залечиванием (репарацией) в старости может нарушаться.
Кроме молекулярных систем репарации ДНК, имеются и другие молекулярные системы защиты и регуляции. Эти системы работают и на внутриклеточном уровне, и на тканевом, и на уровне целостного организма. Мы сосредоточили внимание на первых, хотя будем касаться и более высоких уровней защиты и регуляции. Читателю, который хотел бы познакомиться подробнее с проблемой роли нарушения гомеостаза в старении, автор рекомендует прочитать упомянутую выше очень интересно написанную книгу Г. Н. Кассиля "Внутренняя среда организма", а также труды других ведущих отечественных физиологов и биохимиков, изучающих проблемы старения (И. А. Аршавский, Г. Д. Бердышев, Б. В. Ванюшин, В. М. Дильман, А. И. Зотин, В. Н. Никитин, Д. Ф. Чеботарев, В. В. Фролькис).
|
ПОИСК:
|
© GELIB.RU, 2013-2019
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'