
Инфаркт миокарда
Под инфарктом миокарда понимают очаг некроза миокарда, вызванный несоответствием притока крови в определенный участок миокарда с его потребностями в данный момент. Основной причиной инфаркта является коронарный атеросклероз с развитием тромбоза сосудов.
С увеличением возраста все больше факторов способствуют возникновению инфаркта миокарда, что и определяет столь высокую частоту этого заболевания у людей старших возрастов.
С возрастом снижается значимость фактора психического перенапряжения в развитии инфаркта миокарда, несмотря на то что он все же остается основной ведущей причиной. При этом увеличивается роль физического перенапряжения, пищевых перегрузок, особенно с избыточным потреблением жиров как непосредственной причины возникновения инфаркта миокарда.
ВОЗРАСТНЫЕ ФАКТОРЫ, ПРЕДРАСПОЛАГАЮЩИЕ К КОРОНАРНОМУ ТРОМБОЗУ И ИНФАРКТУ МИОКАРДА
А. Возрастные изменения физико-химических и биохимических свойств крови.
1. Изменение электрокинетических процессов в сосудистом русле.
2. Увеличение адгезивных и агрегационных свойств тромбоцитов.
3. Повышение коагуляционного потенциала (гиперкоагуляция).
4. Снижение функциональных возможностей фибринолитической системы.
5. Нарушение регуляторных механизмов системы гемокоагуляции.
6. Снижение активности липопротеидной липазы.
7. Гиперлипидемия.
8. Увеличение содержания грубодисперсных белков.
Б. Возрастные изменения гемодинамики.
1. Снижение линейной скорости кровотока.
2. Локальное изменение пристеночного кровотока в связи с расширением и извитостью сосудов.
3. Замедление капиллярного кровотока.
4. Изменение реологических свойств крови.
В. Возрастные изменения сосудистой стенки.
1. Гиперпластические и деструктивные процессы (возрастной склероз).
2. Изменение коагуляционно-фибринолитического потенциала.
3. Угнетение липодитических процессов.
4. Извитость и аневризматическое расширение капилляров.
Существенное значение в развитии острой коронарной недостаточности и инфаркта миокарда у людей старших возрастов придают предшествующим острым инфекциям, оперативным вмешательствам [Чеботарев Д. Ф., 1977; Harris R., 1970].
Важной особенностью инфаркта миокарда пожилого и старческого возраста является длительная предшествующая стенокардия, которая обнаруживается у 79% больных, причем ее длительность обычно в 3 раза больше, чем у молодых. Поданным А. Н. Беринской и соавт. (1958), Д. Ф. Чеботарева (1973), предшествующая стенокардия у пожилых больных инфарктом миокарда встречается в 2,5 раза чаще, чей у лиц молодого возраста. Г. А. Кулкыбаев и соавт. (1974) на основании анализа 1024 случаев инфаркта миокарда установили, что средняя продолжительность времени от начала стенокардии до возникновения инфаркта миокарда у молодых была 2,3 года, у лиц среднего возраста - 5,4 года, у пожилых - 5,9 года и у лиц старшего возраста - 9,1 года.
У многих больных пожилого и старческого возраста инфаркту миокарда предшествуют учащение и увеличение продолжительности приступов стенокардии, их появление не только после физической нагрузки, но и в покое. У людей, страдающих гипертонической болезнью, часто повышение артериального давления предшествует инфаркту миокарда.
Убедительных сведений о возрастных особенностях локализации поражения миокарда в литературе нет. Однако Т. А. Демидова (1963) обращает внимание на рост числа задних инфарктов миокарда у людей пожилого и старческого возраста. А. В. Смольянннков и Т. А. Наддачина (1960) нередко обнаруживали вместо тотального некроза множественные сливные очаги повреждения, чередующиеся с некротическими фокусами небольшого размера в субэндокардиальном И интрамуральных отделах.
Патологоанатомические исследования свидетельствуют о том, что крупноочаговые, обширные инфаркты миокарда в пожилом и старческом возрасте наблюдаются значительно реже, чем у молодых. По данным Е. И. Чазова (1972), погибших от инфаркта миокарда в возрасте до 40 лет такие изменения наблюдались в 63,3%, после 60 лет - только в 29,2% случаев.
Клиническая картина. Характеризуя особенности течения инфаркта миокарда в пожилом и старческом возрасте, важно еще раз подчеркнуть, что в большинстве случаев он развивается на фоне выраженного атеросклероза венечных артерий и измененного коронарного кровообращения. Медленное развитие непроходимости коронарных артерий способствует значительной перестройке ангиоархитектоники венечного кровообращения [Смольянников А. В., Наддачина Т. А., 1973], характеризующейся развитием большого количества коллатералей, интра- и интеркоронарных анастомозов. Возникает своеобразный феномен "гиперваскуляризации", который, однако, при стенозирующем коронаросклерозе у пожилых не компенсирует нарушенное венечное кровообращение. Наличие сопутствующих заболеваний, возрастные изменения реактивности также обусловливают главные особенности течения инфаркта миокарда у пожилых и старых людей: необычная клиническая симптоматика, более тяжелое течение, частое возникновение осложнений.
Обращает на себя внимание тот факт, что гипертоническая болезнь и сахарный диабет значительно чаще, чем в молодом возрасте, являются факторами риска в развитии инфаркта миокарда [Малая Л. Т., 1976; Чеботарев Д. Ф., 1977].
По данным О. В. Коркушко с соавт. (1965), гипертоническая болезнь предшествует развитию инфаркта миокарда в 49-52% случаев, по данным Л. И. Алейниковой, А. Е. Золотарева (1976), - в 36%.
Большинство авторов, изучавших инфаркт миокарда у лиц пожилого и старческого возраста, подчеркивают заметное уменьшение частоты типичного ангинозного варианта начала заболевания (Власов К. Ф., Затейщиков В. А., 1962; Чазов Е. И., 19.72, 1978; Кипшидзе Н. Н., 1972, 1976; Малая Л. Т., 1976; Чеботарев Д. Ф., 1977; Geil Т., 1959; Harris R., 1970, и др. 1.
Наряду с этим чаще наблюдаются другие варианты начала инфаркта миокарда (рис. 18). Разнообразие клинических, проявлений, менее выраженный или часто отсутствующий болевой синдром приводят к тому, что инфаркт миокарда часто диагностируется слишком поздно.
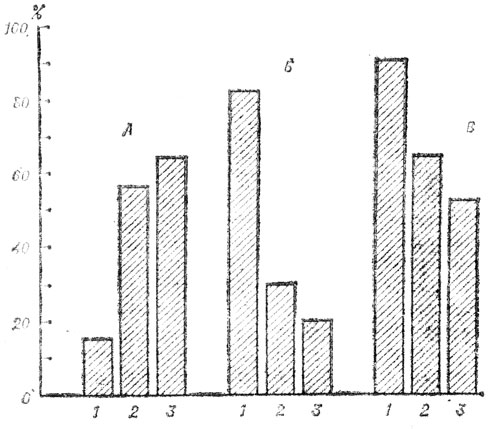
Рис. 18. Некоторые особенности клинического течения инфаркта миокарда у людей различных возрастных групп: 40-59 лет; 2 - 60-74 лет; 3 - 75-89 лет; А - атипичное течение; Б - повышение температуры; В - лейкоцитоз
Уменьшение интенсивности болевого синдрома при инфаркте миокарда у людей пожилого и старческого возраста, по-видимому, объясняется постепенным перерождением нервных элементов в сердечной мышце в результате хронического нарушения венечного кровообращения. Функция рецепторного аппарата снижается, что ухудшает передачу информации в центральную нервную систему. А. Л. Мясников (1960) подчеркивал, что болевые ощущения, стенокардия слабо выражены при медленной ишемизации сердечной мышцы, сниженной вазомоторной реактивности и снижении уровня метаболизма миокарда, что и характеризует атеросклеротическое сердце у пожилых и старых людей.
Кроме того, уменьшение интенсивности болей при инфаркте миокарда у стариков может объясняться повышением порога восприятия болевого раздражения в центральной нервной системе.
Необходимо помнить, что в пожилом и старческом возрасте, как и у молодых, боль при инфаркте миокарда может локализоваться не только в области сердца или за грудиной, но и на периферии. Как и при грудной жабе, боль может отмечаться в шее, нижней челюсти, левой руке или левой лопатке и только через определенный промежуток времени появляться в области сердца. С возрастом все чаще наблюдается безболевой инфаркт миокарда, диагностика которого возможна лишь по данным электрокардиографии и в результате правильной интерпретации возникших осложнений.
У пожилых и старых людей инфаркт миокарда может проявляться внезапными расстройствами ритма: желудочковой экстрасистолией, мерцанием предсердий или желудочковой тахикардией (рис. 19). Последняя является грозным прогностическим признаком для пожилых и старых людей, так как быстро приводит к развитию левожелудочковой недостаточности. Следует указать, что появление у старика после болевого приступа блокады ножек пучка Гиса даже при отсутствии соответствующей симптоматики должно навести на мысль о возможности инфаркта миокарда.
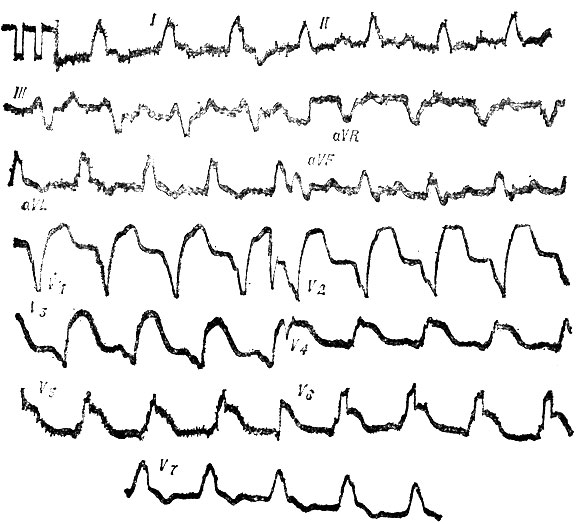
Рис. 19. Острый обширный инфаркт миокарда переднеперегородочной и переднебоковой стенки левого желудочка, осложнившийся суправентрикулярной пароксизмальной тахикардией с нарушением внутрижелудочковой проводимости
По данным Е. И. Чазова (1972), при инфаркте миокарда в возрасте до 40 лет стойкая мерцательная аритмия возникает у 3,2%, в возрасте старше 60 лет - у 15,5% больных. Более часто наблюдается и нарушение функции проводимости - в среднем, пожилом и старческом возрасте оно соответственно встречается в 11,4; 26,9 и 35,6%. Особенно часты нарушения проводимости при инфаркте задней стенки желудочков.
По данным разных авторов, наблюдавших аритмию при инфаркте миокарда без помощи кардиомонитора, нарушения ритма встречаются в 37,7% случаев [Жданова Н. С., 1958], в 54,3% [Лукомский П. Е., Тареев Е. М., 1959]; 47,8% [Теодори М. И., 19591,72,7% [Каневская Л. С., 19691. При кардиомониторном слежении нарушение ритма регистрируется более чем у 90% больных [Гольдберг Н. А., 1968; Чазов Е. И., 1973; Шхвацабая И. К., 1975].
Аритмии наиболее часто возникают в первые 6 дней, однако в старших возрастных группах встречаются и позже, вплоть до 10-го дня. С возрастом увеличивается число тяжелых нарушений ритма и проводимости (мерцание предсердий, желудочковая тахикардия, полная атриовентрикулярная блокада) и комбинированных расстройств (3-4 вида аритмий). У больных старших возрастов при инфаркте, осложненном аритмиями, наиболее высоки показатели летальности.
В этом возрасте чаще по сравнению с молодыми людьми встречается астматический вариант инфаркта миокарда в виде сердечной астмы различной тяжести при слабо выраженном болевом синдроме либо отсутствии болевых ощущений в области сердца и за грудиной. Причиной более частого возникновения левожелудочковой недостаточности у пожилых и старых людей является значительное снижение резервных возможностей сердца. Это связано с тем, что даже у физиологически стареющих людей вследствие возрастных изменений миокарда существует так называемая функциональная сердечная недостаточность, и наслаивающаяся катастрофа в виде ннфаркта миокарда весьма легко обусловливает резкое падение сократительной способности миокарда. Чаще, чем у людей среднего возраста, наблюдаются признаки сердечной недостаточности и в постинфарктном периоде, когда вслед за левожелудочковой недостаточностью развивается тотальная недостаточность кровообращения.
По нашим данным [Коркушко О. В. и соавт., 19651, острая сердечная недостаточность у пожилых людей при остром инфаркте миокарда наблюдается в 14,2%, у стариков - в 21,4% случаев. Близкие к этим данные получены Solem и соавт. (1963), наблюдавшими острую сердечную недостаточность при остром инфаркте миокарда в возрасте от 30 до 39 лет в 7 %, от 40 до 49 лет - в 19% и после 50 лет - в 24% случаев. По данным Е. И. Чазова и соавт. (1967), этот вид осложнения встречается у 61,6% больных.
В этой связи изучение гемодинамики при инфаркте миокарда имеет большое практическое значение, так как помогает своевременно выявить развитие сердечной недостаточности и проводить в каждом конкретном случае адекватную терапию.
Причиной возникновения сердечной недостаточности при инфаркте миокарда могут быть следующие факторы:
- выпадение части функционирующей мускулатуры желудочков;
- нарушение сердечного ритма;
- увеличение потребления кислорода сердцем вследствие повышенного выделения катехоламинов.
Кардиогенный шок чаще наблюдается при крупноочаговых повторных инфарктах миокарда, однако у пожилых больных осложнение может развиваться и при мелкоочаговых. Патогенез его сложен. Принято считать, что ведущим механизмом его развития является снижение сердечного выброса вследствие появления обширного некроза и ослабленной сократительной способности непораженных отделов миокарда.
Помимо истинного кардиогенного шока, выделяют рефлекторный (болевой), при котором развитие сосудистой недостаточности (снижение сосудистого тонуса) связано рефлекторно с болевым синдромом. У пожилых и старых людей вследствие малой выраженности болевого синдрома он встречается значительно реже и почти всегда сопровождается снижением сердечного выброса в результате ослабления сократительной способности миокарда, тогда как у молодых больных при этом виде шока минутный объем крови может оставаться неизменным либо его отклонения незначительны. При своевременной терапии такой шок удается легко устранить. Однако следует помнить, что без соответствующей коррекции, особенно у пожилых больных, он может перейти в ареактивную форму в результате развития выраженных гемодинамических нарушений.
Необходимо также указать на аритмическую форму кардиогенного шока, патогенез которого связан с падением минутного объема крови в результате тахи- и брадиаритмий. Так, значительное учащение ритма, что может наблюдаться при пароксизмальных тахикардиях, и его резкое замедление, что имеет место при нарушении атриовентрикулярной проводимости (III, IV стадии), может обусловить падение сердечного выброса и тем самым развитие шока.
У больных старших возрастов чаще наблюдаются тяжелые формы кардиогенного шока, обусловленные как значительным ослаблением сократительной способности миокарда, так и возрастной перестройкой регуляции сосудистого тонуса.
Как известно, снижение минутного объема обычно компенсируется уменьшением емкости периферического сосудистого русла, что позволяет поддерживать артериальное давление крови на адекватном уровне. Однако, как уже указывалось, с возрастом нервные влияния на сердечнососудистую систему ослабляются, поэтому при падении минутного объема крови не может быстро и адекватно перестроиться периферическое кровообращение. Общее периферическое сопротивление возрастает в меньшей степени, чем снижается сердечный выброс.
В свою очередь, уменьшение сердечного выброса, снижение артериального давления крови и сосудистый спазм создают неблагоприятные условия для периферического кровообращения, микроциркуляции в различных органах и тканях. Развиваются гипоксия, ацидоз, метаболические расстройства. Несомненно вследствие уже существующих возрастных изменений микроциркуляции этому механизму, очевидно, следует уделять большее внимание при проведении терапевтических мероприятий.
При снижении систолического давления в аорте ниже 80 мм рт. ст. коронарный кровоток резко уменьшается, что приводит к метаболической недостаточности миокарда, а это, в свою очередь, - к снижению сократительной способности миокарда. Возникает порочный круг: снижение сократительной способности миокарда при инфаркте ведет к падению минутного объема, кардиогенному шоку; снижение перфузионного давления ухудшает условия коронарного кровообращения, ослабляя сократительную способность миокарда.
При кардиогенном шоке, особенно у пожилых и старых больных, наблюдаются выраженные нарушения кровоснабжения всех жизненно важных органов. Так, снижение почечного кровотока ведет к развитию почечной недостаточности и появлению азотемии.
Если на ранних этапах тяжесть кардиогенного шока зависит от функционального состояния миокарда, то в дальнейшем нарушения микроциркуляции, изменения реологических свойств крови, метаболизма тканей определяют течение и исход заболевания. Отсюда становится понятным, почему главным принципом лечения является раннее применение патогенетической терапии, и чем раньше начато лечение, тем выше его эффективность. Особенно это важно для пожилых и старых больных.
Кардиогенный шок чаще возникает в первый день инфаркта миокарда, однако у пожилых и старых больных может развиваться и в последующие дни.
Из клинических симптомов кардиогенного шока наиболее важными для диагностики являются снижение систолического артериального давления ниже 80 мм рт. ст. и олигурия (менее 20 мл в час). Однако у больных с исходной артериальной гипертензией симптомы шока могут развиться при снижении систолического давления крови до 120-100 мм рт. ст.
Существенно осложняют течение кардиогенного шока сопутствующие нарушения ритма и проводимости, развитие застойной недостаточности сердца и появление метаболического ацидоза.
Для оценки тяжести шока М. Я. Руда и А. П. Зыско (1977) предлагают ориентироваться на следующие показатели: 1) длительность существования шока, 2) реакция на прессорные препараты (при тяжелом течении шока вазопрессорные препараты оказываются неэффективными), 3) выраженность расстройств кислотно-щелочного состояния, 4) выраженность олигурии, 5) уровень артериального давления.
Часто у больных пожилого возраста при инфаркте миокарда возникают динамические нарушения мозгового кровообращения. Важнейшими симптомами являются головокружение, головная боль, шум в ушах, рвота, нарушение речи, обморочное состояние и др. Патогенез острых расстройств мозгового кровообращения сложен и объясняется рефлекторными ангиоспастическими реакциями, падением артериального давления, уменьшением мозгового кровотока в связи со снижением сердечного выброса. Последние два фактора у пожилых и старых больных играют нередко основную роль в развитии этих нарушений.
В некоторых случаях инфаркт миокарда сочетается с инсультом, но иногда изменения ЭКГ, характерные для острой ишемии миокарда или инфаркта миокарда, могут появляться при цереброваскулярных катастрофах, при отсутствии органических поражений сердца.
Гастралгическая форма чаще встречается при инфаркте задней стенки. Этот вариант инфаркта миокарда начинается с острых или подострых болей в подложечной области с тошнотой, иногда рвотой и расстройством стула. Однако при внимательном осмотре обращают на себя внимание тахикардия, снижение артериального давления, уменьшение звучности тонов сердца. Нет сомнения, что болевые проявления со стороны брюшных органов в основном рефлекторного происхождения, хотя не исключена возможность одновременного нарушения кровообращения в сосудах брюшной полости. Гастралгическая форма инфаркта миокарда может симулировать клиническую картину обострения и даже перфорации язвы желудка или двенадцатиперстной кишки, острого панкреатита и дать повод к необоснованному оперативному вмешательству. У старых людей чаще проявляется только ощущением дискомфорта в эпигастральной области или даже в нижнем отделе живота, иногда с позывами на мочеиспускание [Чеботарев Д. Ф., 1977].
Заслуживают внимания так называемые немые, или латентные, и н ф аркты миокарда у пожилых больных, которые нередко являются своеобразной электрокардиографической находкой [Гуревич М. А., 1970; Чазов Е. И., 1972; Шхвацабая И. К., 1975; Чеботарев Д. Ф., 1977; Harris R., 1970].
Д. А. Демидова (1963) приводит случаи необычного течения инфаркта миокарда у старых людей с температурной реакцией под маской "простудного заболевания", а также "радикулярные маски" и др.
У пожилых больных инфарктом миокарда увеличивается риск тромбоэмболических осложнений. Обычно наблюдаются поражения легочной артерии, абдоминального отдела аорты, артерий ннжннх конечностей, мезентериальных артерий, мозговых сосудов. В их возникновении прежде всего играют роль депрессия противосвертывающей системы крови, повышение содержания коагулянтов в крови, нарушение кровообращения. Следует подчеркнуть, что в связи с широким применением антикоагулянтов и тромболизирующих препаратов частота тромбоэмболических осложнений при инфаркте миокарда значительно снизилась и уменьшилась их тяжесть. Однако у пожилых и старых людей эти осложнения остаются достаточно частыми.
Тромбоэмболии легочной артерии и ее ветвей чаще всего возникают вследствие тромбофлебита или флеботромбоза нижних конечностей, зависящих от гемодинамических нарушений, изменения свертываемости крови в этот период, а также ограничения подвижности. При замедлении кровотока в системе легочной артерии в результате сердечной недостаточности также могут возникнуть условия, способствующие развитию тромбоза легочной артерии.
Разрывы сердца при инфаркте миокарда у старых людей также случаются чаще, чем у молодых [Вихерт A. М., Матова Е. Е., 1966; Смольянников А. В., Наддачина Т. А., 1967; Виноградов А. В., 1971]. Помимо внешних разрывов сердца с тампонадой перикарда, некоторые авторы обращают внимание на частоту разрывов межжелудочковой перегородки и папиллярных мышц.
Разрыв межжелудочковой перегородки, как и разрыв стенки желудочка, сопровождается резкой болью в области сердца, развитием кардиогенного шока, быстро нарастающими признаками острой, правожелудочковой недостаточности. Обнаруживается грубый систолический шум по обе стороны грудины на уровне третьего-четвертого межреберных промежутков, шум распространяется слева направо, определяется систолическое дрожание. Систолический шум может выслушиваться и в межлопаточном пространстве. На ЭКГ выявляются признаки перегрузки правых отделов сердца. Часто возникает нарушение ритма и особенно проводимости - полная поперечная блокада.
Разрыв сосочковой мышцы обусловливает развитие тяжелой недостаточности митрального клапана и проявляется развитием острой левожелудочковой недостаточности (кардиальная астма, отек легких). Часто присоединяется кардиогенный шок. Характерным симптомом является грубый систолический шум с эпицентром на верхушке.
Контрастная кардиография, сцинтикардиография, эхо-кардиография, измерение давления в полостях сердца помогают в диагностике указанных осложнений. Хотя оперативное вмешательство у таких больных опасно, тем не менее имеются сообщения об успешном хирургическом восстановлении дефекта межжелудочковой перегородки даже у пожилых больных. Выживание таких больных при хирургическом лечении стало возможным вследствие усовершенствования хирургических и диагностических методов, а также благодаря интенсивному уходу [Harris R., 1970].
Аневризмы сердца после инфаркта миокарда в пожилом возрасте, по мнению А. А. Гальперина (1963), З. К. Трушинского и соавт. (1968), развиваются чаще, чем у молодых, однако Р. О. Кушкий, Н. И. Маркова (1958), В. Е. Фрадкина (1965), М. Т. Сольцева и соавт. (1965), И. П. Баловнев, Р. И. Томилина (1966) не обнаружили существенной разницы в частоте постинфарктных аневризм в зависимости от возраста больных. В противоположность перечисленным выше данным Е. И. Чазов и соавт. (1967) отметили меньшую частоту аневризм при инфаркте миокарда у больных пожилого и старческого возраста: они выявили это осложнение всего у 5,5% больных.
Аневризма сердца развивается при обширных, обычно трансмуральных инфарктах миокарда чаще всего у лиц с исходным повышенным артериальным давлением, при грубом нарушении постельного режима в первые дни заболевания. При развитии аневризмы сердца течение инфаркта обычно тяжелое - развивается сердечная недостаточность. Для аневризмы передней стенки характерна патологическая пульсация в прекардиальной области. Часто наблюдается расширение границ сердца, ослабление первого тона, протодиастолический ритм галопа, систолический шум вследствие относительной недостаточности митрального клапана, реже выслушивается диастолический шум. Над областью аневризмы иногда можно обнаружить своеобразный резкий шум высокого тембра - "шум писка". На фонокардиограмме этот шум имеет систолодиастолический характер. На ЭКГ чаще обнаруживается "застывшая" монофазная кривая в соответствующих отведениях. В ряде случаев аневризму сердца можно заподозрить при наличии зубца Q в нескольких отведениях и стойкого, сохраняющегося на протяжении нескольких лет, глубокого остроконечного зубца T при дугообразном сегменте ST. Эхо- кардиография, электро- и рентгенокимография, контрастная вентрнкулография помогают в диагностике этого осложнения.
Следует считать, что типичный пост инфарктный синдром (синдром Дресслера) как своеобразное осложнение острого инфаркта миокарда, протекающий с лихорадкой, перикардитом, плевритом и пневмонией, у пожилых и старых людей встречается крайне редко в связи со сниженной общей реактивностью организма.
Как в остром, так и особенно в подостром периоде инфаркта миокарда часто встречаются нарушения функции желудочно-кишечного тракта. Клинический опыт свидетельствует, что наиболее выраженные проявления желудочно-кишечного синдрома наблюдаются в течение первой недели болезни (метеоризм, запоры, отрыжка, ослабление тонуса мускулатуры желудка и кишечника вплоть до развития тяжелой атонии с сопутствующим расстройством кровообращения в мезентериальных сосудах). В возникновении этих нарушений имеют значение рефлекторные влияния, нарушение кровообращения, а также медикаментозный фактор - применение больших доз морфинных препаратов, атропина.
Причинами эрозий, острых язв желудка и кишечника, наблюдаемых при инфаркте миокарда у пожилых и старых людей, являются нарушение кровообращения в мезентериальных сосудах на фоне возрастных изменений слизистой, а также ослабление трофических стимулирующих влияний нервной системы, что и обусловливает пониженную сопротивляемость слизистой оболочки желудочно-кишечного тракта.
При инфаркте миокарда динамический илеус обычно связан с ишемией желудочно-кишечного тракта вследствие снижения артериального давления и падения минутного объема крови. Развитию этого осложнения способствует также повышение тонуса симпатической нервной системы. Перистальтика резко замедляется и возникает угроза для жизнеспособности кишечной стенки [Harris R., 1970]. Чаще эти нарушения возникают при тяжелом течении инфаркта, когда имеют место выраженные нарушения гемодинамики (сердечная недостаточность, кардиогенный шок).
Нарушения функции внешнего дыхания, связанные с возрастными изменениями, сопутствующими заболеваниями легких, могут значительно усиливаться при инфаркте миокарда. Речь идет об одышке, связанной с легочной недостаточностью, и бронхоастматическом синдроме. У старых людей часто наблюдаются гилостатические пневмонии (Киреев П. М. и соавт., 1973].
Психозы в большинстве случаев развиваются на первой неделе заболевания. Основными причинами их возникновения у пожилых больных являются ухудшение церебрального кровообращения и гипоксемия, вызванные сердечной недостаточностью. Этому способствуют и атеросклеротические изменения мозговых сосудов, столь часто встречающиеся в этом возрасте. Чаще всего психоз возникает в вечерние и ночные часы и протекает в форме делирия [Руда М. Я., Зыско А. П., 1977].
У пожилых и старых больных, особенно у мужчин с аденомой предстательной железы в остром периоде, часто наблюдается острая задержка мочи вследствие атонии мочевого пузыря. Это нарушение нередко усугубляется и некоторыми медикаментами, применяемыми при инфаркте миокарда.
Гипергликемия и глюкозурия у больных острым инфарктом миокарда обусловлены стресс-реакцией. Однако, если они удерживаются более 2 нед, можно заподозрить сахарный диабет [Harris R., 1970].
Температурная реакция часто отсутствует у людей старших возрастных групп, особенно при развитии мелкоочаговых инфарктов, и у стариков с выраженным одряхлением, что вполне можно объяснить снижением реактивности стареющего организма.
Если температура держится более недели, то это должно вызвать в первую очередь подозрение о развитии следующих осложнений: пневмонии, легочной эмболии, воспалительного процесса в мочевыводящей системе, о рецидивирующем течении инфаркта.
Мелкоочаговый инфаркт характеризуется развитием мелких очагов некроза в сердечной мышце. Клинические проявления его у пожилых и старых людей могут быть очень разнообразными; основой диагностики являются изменения ЭКГ и их учет в динамике.
Изменения крови при мелкоочаговом инфаркте выражены слабее, чем при крупноочаговом, и сохраняются в течение относительно короткого времени. Повышение активности ферментов кратковременно и незначительно. Протекает относительно благоприятно, однако у пожилых и старых больных чаще, чем у молодых, наблюдаются нарушения ритма, развитие сердечной недостаточности.
Нередко у больных инфаркт миокарда приобретает затяжное или рецидивирующее течение, при котором в пределах 2-21/2 мес от начала заболевания происходит повторное инфарцирование, т. е. в тот период, когда еще не закончился первичный некротический процесс, не наступило полного рубцевания.
Затяжное течение инфаркта миокарда наблюдается чаще у пожилых больных с резко выраженным атеросклерозом коронарных артерий [Руда М. Я., Зыско А. П., 1977]. Обычно очаги некроза располагаются в участках миокарда, прилежащих к первичному инфаркту. Течение рецидивирующего инфаркта миокарда у пожилых обычно тяжелее. Значительно выше оказывается и летальность. Часто развиваются сердечная недостаточность, нарушение ритма сердца и проводимости. Болевой синдром чаще всего слабо выражен. Наблюдается субфебрильная температура, увеличение СОЭ, повышение активности ферментов сыворотки крови. Обнаружение на ЭКГ изменений, свидетельствующих об ухудшении коронарного кровообращения, в сочетании с указанными клиническими проявлениями дает основание говорить о рецидивирующем течении инфаркта миокарда.
Повторный инфаркт миокарда сравнительно часто встречается среди больных пожилого и старческого возраста. Е. Ф. Власов и В. А. Затейщиков выявили его у 33,3% больных, Е. И. Чазов и соавт. (1967) - у 35,1%, М. А. Гуревич (1968, 1973) - у 25%; мы также отметили у них более частое возникновение повторных инфарктов [Коркушко О. В. и соавт., 1965]: у молодых повторный инфаркт миокарда наблюдался в 10%, у пожилых - в 18%, у старых - в 22%.
Повторный инфаркт может быть крупноочаговым и мелкоочаговым. В отличие от пролонгированного инфаркта повторный инфаркт развивается через несколько месяцев или лет, т. е. после полного рубцевания предыдущего очага, чаще всего в бассейнах других коронарных артерий. У пожилых чаще всего протекает атипично, наблюдается слабо выраженный болевой синдром, часто осложняется развитием острой и хронической сердечной недостаточности, тяжелыми нарушениями ритма и проводимости [Виноградов А. В., 1971]. Летальность при повторном инфаркте значительно выше, чем при первичном.
Диагностика. Необычное течение коронарной недостаточности у пожилых и старых людей вынуждает быть очень внимательным к жалобам на внезапное ощущение слабости, потерю сознания, приступы одышки, удушья, появление аритмии, так как они могут быть симптомами развивающегося инфаркта миокарда.
При распознавании продромального периода инфаркта миокарда важно установить изменение характера стенокардии, уменьшение толерантности к физической нагрузке и смену стенокардии напряжения стенокардией покоя, исчезновение лечебного эффекта от приема нитроглицерина, нарастание изменений ЭКГ, которые можно условно трактовать как ухудшение коронарного кровообращения (смещение сегмента ST, уменьшение амплитуды зубца T, его изоэлектричность, появление двухфазного, отрицательного зубца T).
Достоверная диагностика инфаркта миокарда базируется на инструментальных и лабораторных методах исследования. Распознать инфаркт миокарда у пожилых и старых людей труднее, чем у людей среднего возраста, не только в связи с малой выраженностью и необычностью многих клинических симптомов, но также вследствие многих других патологических поражений организма и уже существующих изменений ЭКГ.
Основным методом диагностики инфаркта миокарда, его локализации, обширности, выявления ряда осложнений (аневризма сердца, нарушение сердечного ритма, проводимости) является электрокардиографическое исследование.
При развитии крупноочаговых инфарктов миокарда у больных пожилого и старческого возраста обычно нет затруднений в их диагностике, так как характер изменений сегмента ST, зубца T и комплекса QRS обычно соответствует таковому у людей более молодого возраста. Эти особенности весьма подробно освещены в соответствующих монографиях. Однако в острой фазе инфаркта часто не наблюдается выраженных смещений сегмента ST, а в основном изменения касаются зубца T. Он становится отрицательным в нескольких отведениях соответственно зоне поражения миокарда, приобретает заостренный вид. Особенно большие затруднения в диагностике возникают при блокаде левой ножки пучка Гиса. При этом следует подчеркнуть, что этот вид нарушений часто встречается у пожилых и старых людей. Признаком развития инфаркта при блокаде левой ножки пучка Гиса служит появление зубца Q в I стандартном отведении, в aVL, а также левых грудных отведениях. Важным признаком, подтверждающим наличие инфаркта миокарда, может быть уменьшение амплитуды зубца R, особенно в грудных отведениях, или появление зазубренности зубца R, появление комплекса типа rS в левых грудных отведениях, исчезновение характерной для блокады левой ножки пучка Гиса дискордантности комплекса QRS и зубца T.
У пожилых и старых людей отрицательный зубец T в грудных отведениях часто может сохраняться в течение многих лет, являясь признаком перенесенного инфаркта.
При мелкоочаговом инфаркте наблюдаются изменения только сегмента ST и зубца T, комплекс QRS обычно не изменен. Сегмент ST может быть несколько смещен вверх или вниз от изоэлектрической линии. Зубец T может становиться "коронарным", в некоторых случаях двухфазным. Обычно зубец T остается отрицательным на протяжении 1-2 мес.
Трактовка изменений ЭКГ при повторном инфаркте затруднена в связи с наличием изменений, оставшихся от предыдущего поражения. Так, в некоторых случаях можно наблюдать нивелирование ранее имевшихся изменений (так называемая псевдонормализация ЭКГ): например, появление положительного зубца T вместо негативного или повышение сниженного ранее сегмента ST до изоэлектрической линии.
На вектор кардиограмме у больных инфарктом возникают неровности петли QRS, дополнительные выступы. При этом ценным для диагностики является дополнительный полюс петли QRS, ориентированный в противоположную ее основной части сторону. Заметное уменьшение площади петли QRS также является признаком очаговых изменений в миокарде. При острой коронарной недостаточности без явлений некроза миокарда указанные признаки не регистрируются.
Для обнаружения начальных, доклинических проявлений сердечной недостаточности и оценки эффективности проводимой терапии у больных инфарктом миокарда большое значение имеют инструментальные методы исследования.
Снижение сократительной способности мышцы сердца при инфаркте, что так часто отмечается у пожилых и старых больных, находит свое отражение в изменении фазовой структуры систолы. Сущность этих изменений заключается в удлинении периода напряжения миокарда за счет увеличения фазы изометрического сокращения сердца. При этом может отмечаться укорочение электромеханической систолы за,счет уменьшения периода изгнания крови. Эти изменения, однако, не носят специфического характера, так как отражают лишь снижение контрактильной способности миокарда. Использование эхо кардиографии также позволяет оценить сократительную способность миокарда, интракардиальную гемодинамику, определить зоны акинезии, дискинезии.
В последние годы для изучения интракардиальной гемодинамики Используются гамма-камеры с введением радиоактивных изотопов в правые отделы сердца или в периферические вены. Метод получил название сцинтиангио кардиографии. С его помощью удается получить представление о форме полостей сердца, крупных сосудов, наличии регургитации, шунтов, выявить области акинезии, дискинезии, парадоксальной пульсации, определить объем левого желудочка в конце систолы и диастолы, фракцию выброса и другие показатели, имеющие большое значение для оценки функционального состояния миокарда, гемодинамики. Представляется также возможной визуализация очагов некроза при введении различных изотопов, имеющих тропность к живой или, наоборот, некротической ткани [Руда М. Я., 1977].
Для диагностики различных форм ишемической болезни сердца важное значение приобретают лабораторные исследования. Так, при неосложненной стенокардии не наблюдается сдвига в белковых фракциях крови, тогда как при мелкоочаговом и крупноочаговом инфаркте миокарда нарастает уровень глобулинов и уменьшается количество альбуминов.
У пожилых и стариков более отчетливо, чем в молодом возрасте, увеличивается количество фибриногена в сыворотке крови. В отличие от более молодых больных уровень фибриногена и через месяц после острого приступа инфаркта миокарда нередко превышает норму [Любченко В. В., 1978]. Заслуживает внимания определение в крови продуктов распада фибриногена. Так, повышение в крови концентрации мелко- и крупнодисперсных дериватов фибриногена и фибрина является признаком возбуждения свертывающей системы крови и первичной или вторичной активации фибринолитической системы.
Реакция крови у старых людей (увеличение количества лейкоцитов, изменение формулы крови, СОЭ) выражена значительно слабее, чем у молодых. Если кровь исследовалась незадолго до наступления инфаркта, необходимо сравнивать данные в динамике с теми, которые получены во время заболевания. При этом нужно помнить о том, что повышенная СОЭ нередко наблюдается у практически здоровых лиц и обусловлена изменением белкового состава крови [Чеботарев Д. Ф., 1977]. Чаще отмечается и положительная реакция на С-реактивный белок, что, возможно, связано с более легкой деструкцией гистогематических барьеров в старческом возрасте.
Весьма перспективной в настоящее время считается ферментная диагностика острого инфаркта миокарда, который сопровождается увеличением активности в крови аспартат-аминотрансферазы, аланин-аминотрансферазы, креатинфосфокиназы (КФК), лактатдегидрогеназы. Диагностическая ценность определения этих энзимов при инфаркте миокарда у пожилых и старых больных остается сомнительной, некоторые авторы считают, что возрастные изменения обменных процессов, проницаемости могут оказать существенное влияние на активность и выход ферментов в кровь из поврежденного миокарда.
Отмечено, что аспартат-аминотрансфераза, аланин-аминотрансфераза, креатинфосфокиназа при инфаркте миокарда повышаются в крови в течение первых суток, и обычно к 5-6-му дню наблюдается их нормализация, тогда как уровень лактатдегидрогеназы приходит к норме лишь на 10-15-й день заболевания.
Вместе с тем многие из указанных ферментов повышаются и при других заболеваниях. Так, при сердечной декомпенсации, миокардите, шоке может наблюдаться высокий уровень аспартат-аминотрансферазы. Отмечено также ее повышение при панкреатите, холецистите, гепатите, при повреждении мышц и их воспалении, при приеме антикоагулянтов. Однако при инфаркте легкого, перикардите ее активность обычно нормальная, в связи с чем этот показатель может быть использован для дифференциальной диагностики указанных состояний.
Повышение лактатдегидрогеназы, кроме инфаркта миокарда, может наблюдаться также и при других заболеваниях, связанных с некрозом тканей, при лейкемии, остром тиреоидите, мышечной дистрофии, панкреатите, хроническом гломерулонефрнте, пернициозной или гемолитической анемии, болезнях печени, инфаркте легкого и обширном раковом поражении.
Существенным шагом вперед в диагностике инфаркта миокарда явилось определение изоэнзимов лактатдегидрогеназы (ЛДГ). В клинической практике определяют 5 изоэнзимов ЛДГ. Показано, что каждый орган характеризуется определенным изоэнзимным профилем. Так, при инфаркте миокарда вначале увеличивается уровень ЛДГХ, тогда как уровень общей ЛДГ может оставаться неизменным. В то же время при тромбоэмболии легочной артерии увеличивается уровень ЛДГ2, ЛДГ3. Следует помнить, что электро- импульсная терапия также может вызвать увеличение уровня ЛДГ за счет освобождения фермента из скелетных мышц.
Таким образом, изучение активности изоэнзимов ЛДГ не только повышает информативность этого теста в диагностике инфаркта миокарда, но и облегчает дифференциальную диагностику при наличии других сопутствующих заболеваний.
В последние годы появились также сообщения, касающиеся исследования изоэнзимного спектра креатинфосфокиназы. Показано, что в скелетной мускулатуре содержится изофермент, состоящий из двух субъединиц мышечного типа (ММ), тогда как в миокарде наряду с ферментом ММ имеется фермент MB, состоящий из одной субъединицы мышечного типа и одной - мозгового типа В (от английского слова brain - мозг). По мнению М. Я. Руды (1977), увеличение в крови нзофермента типа MB является высокоинформативным признаком инфаркта миокарда.
Важное значение для лечения и прогноза имеет определение величины инфаркта миокарда. Кроме электрокардиографических показателей, критериями величины некроза могут служить результаты исследования некоторых ферментов в сыворотке крови. Наибольшего внимания заслуживает динамическое изучение активности креатиифосфокиназы, в особенности ее сердечного изофермента.
Дифференциальная диагностика. При типичном течении диагностика инфаркта миокарда обычно не представляет трудностей. Длительная интенсивная загрудинная боль, тахикардия, приглушенность тонов сердца, повышение температуры, лейкоцитоз со сдвигом влево, изменение соотношений белковых фракций, увеличенная СОЭ, гиперферментемия, характерные изменения ЭКГ - все это позволяет в нужный момент заподозрить и подтвердить диагноз инфаркта. Наличие сопутствующих заболеваний, малая выраженность симптомов инфаркта миокарда и его необычное течение часто затрудняют диагностику. Только развитие осложнений в совокупности со всей клинической картиной позволяет выявить это заболевание, т. е. диагноз является ретроспективным.
В диагностике инфаркта миокарда встречается два вида ошибок: инфаркт миокарда ошибочно расценивают как другое заболевание либо, наоборот, та или иная патология трактуется как инфаркт. Часто острую левожелудочковую недостаточность при инфаркте миокарда, если она протекает на фоне повышенного артериального давления, расценивают как проявление гипертонического криза; кардиогенный шок при безболевом инфаркте миокарда, если он сопровождается сопорозным состоянием, часто трактуют как неврологическую кому.
Гастралгическая форма инфаркта миокарда нередко расценивается как пищевое отравление, перфоративная язва желудка, острый холецистит, панкреатит.
Инфаркт миокарда при наличии болей в грудной клетке нередко трактуется как пневмония, плеврит. Локализация боли в тех областях, куда она обычно иррадиирует, может привести к неправильному диагнозу плексита или остеохондроза с корешковым синдромом.
Большие трудности в дифференциальной диагностике представляют эмболии легочной артерии. Это связано с тем, что при этой патологии могут также наблюдаться и загрудинные боли, и рефлекторный коллапс. Диагностика часто зависит от правильной интерпретации ЭКГ. В ряде случаев изменения при эмболии легочной артерии напоминают инфаркт миокарда задней стенки, отличаясь только наличием признаков перегрузки правого желудочка. В разграничении этих состояний помогает изменение ферментного спектра крови - повышение уровня ЛДГ-2.
Важно заметить у больных эмболией легочной артерии признаки выраженной гипоксии, острой правожелудочковой недостаточности. Следует учитывать и то обстоятельство, что тромбоэмболия легочной артерии чаще наблюдается у больных в послеоперационном периоде, особенно при операциях в брюшной полости, малом тазу, у больных тромбофлебитом, флеботромбозом нижних конечностей, при клапанных пороках сердца.
Расслаивающая аневризма аорты имеет сходную клиническую картину, однако при этом, как правило, соответствующие изменения ЭКГ отсутствуют, активность ферментов сыворотки крови в пределах нормы.
Спонтанный пневмоторакс, особенно левосторонний, также может быть причиной резких болей в грудной клетке и может обусловить развитие острой сосудистой недостаточности. Наличие тимпанита над соответствующей половиной грудной клетки, резкое ослабление дыхания, отсутствие характерных для инфаркта миокарда изменений ЭК1 , а также гиперферментемии позволяет разграничить эти состояния.
Острый перикардит обычно сопровождается характерными изменениями ЭКГ. Активность креатинфосфокиназы, лактатдегидрогеназы и аминотрансфераз при перикардите обычно не повышена.
Прогноз. Инфаркт миокарда у пожилых и старых людей протекает значительно тяжелее, чем у больных молодого возраста, не только в первые часы его возникновения, но и в последующие дни и недели. Смертность в этом возрасте также значительно выше [Чазов Е. И., 1971; Грицюк А. И., 1973].
По данным Г. А. Кулкыбаева с соавт. (1974), летальность среди больных инфарктом миокарда молодого возраста составляет 6,1%, среднего возраста - 9%, пожилого и старческого возраста - соответственно 17,9 и 30%. По данным S. Richard (1973), у молодых летальность составляет 10-12%, у пожилых и старых - 32%. Согласно наблюдениям некоторых авторов, 50% больных в возрасте 80-89 лет не переживают инфаркта миокарда.
В пожилом и старческом возрасте увеличение опасности летального исхода связано с более частым развитием недостаточности кровообращения, тяжелых нарушений ритма, тромбоэмболических осложнений, разрывов сердца, нарушений мозгового кровообращения [Смольянников А. В. и соавт., 1966; Вихерт А. М., Матова Е. Е., 1966]. К тому же у больных этого возраста часто имеется сопутствующая патология других органов и систем, что значительно отягощает течение инфаркта миокарда [Ильинский Б. В. с соавт., 1972; Harris R., 1970].
Возраст больных инфарктом миокарда существенно влияет не только на ближайший, острый период заболевания, но и на отдаленный жизненный и трудовой прогноз. Среди лиц старших возрастных групп, перенесших инфаркт миокарда, значительно ниже возможность полной медицинской и профессиональной реабилитации [Хвиливицкая М. И., Танюхина Э. И., 1968; Чеботарев Д. Ф., 1977]. Об этом свидетельствуют данные Д. Ф. Чеботарева с соавт. (1973), проследивших судьбу 311 больных, перенесших инфаркт миокарда в возрасте от 30 до 90 лет. Около половины из них были в возрасте старше 60 лет. В течение первых 5 лет после перенесенного инфаркта среди группы лиц моложе 40 лет умерли 12,5%, среди лиц старше 60 лет - 65%. Наибольшая смертность наблюдалась в течение первого года, особенно при передне-заднем инфаркте. Близкие к этим данные получены и другими авторами.
У больных, перенесших острый инфаркт миокарда, увеличивается вероятность внезапной смерти, и в первые 12 мес она составляет 30% [Lovell R., 1969]. Причиной внезапной смерти после перенесенного инфаркта миокарда являются повторные инфаркты, нарушения ритма, разрывы сердца.
Общие принципы лечения. Терапия острого инфаркта миокарда проводится по тому же принципу, что и в более молодом возрасте, и предусматривает следующие мероприятия: 1) купирование болевого синдрома; 2) мероприятия, проводимые с целью возможного ограничения зоны некроза; 3) поддержание сократительной функции сердца с помощью гликозидов; 4) борьба с гипоксией; 5) борьба с тромбообразованием; 6) профилактика и лечение нарушений сердечного ритма, сердечной недостаточности, шока; 7) реабилитация.
Кроме того, разнообразные осложнения инфаркта миокарда могут потребовать специального дополнительного лечения.
При подозрении на инфаркт миокарда больной подлежит срочной госпитализации, так как наиболее эффективные лечебные мероприятия можно провести только в условиях стационара.
Купирование болевого синдрома является первоочередной задачей, так как боль может вызвать ряд осложнений вплоть до развития шока. С целью уменьшения побочного действия и усиления обезболивающего эффекта используют комбинацию наркотических анальгетиков (морфина, промедола, омнопона) с атропином и антигистаминными препаратами (димедрол, пипольфен, дипразин, супрастин). Целесообразно также сочетание их с нейролептиками (аминазин, дроперидол, галоперидол), так как они потенцируют действие наркотиков. В зависимости от клинических особенностей можно создавать различные комбинации для внутривенного и внутримышечного введения. Для профилактики угнетения дыхательного центра можно использовать 2-3 мл кордиамина.
Особенно эффективна для купирования ангинозного приступа нейролептанальгезия, которая осуществляется синтетическим анальгетиком фентанилом (0,05-0,1 мг) и нейролептиком дроперидолом (дегидробензперидол) в дозе 5 мг. Часто используется готовая смесь этих препаратов - таламонал. Следует помнить, что у пожилых больных при введении этих препаратов может наблюдаться снижение артериального давления крови и угнетение дыхательного центра. Поэтому показано введение кордиамина.
К достоинствам нейролептанальгезии при инфаркте миокарда следует отнести также способность указанных препаратов улучшать периферическое кровообращение, устранять острую левожелудочковую недостаточность: сердечную астму, отек легких [Малая Л. Т., Волков В. И., 1979].
Применение наркоза смесью закиси азота с кислородом по общепринятой схеме является эффективным методом борьбы с ангинозным приступом. Его действие потенцируют небольшие дозы наркотических анальгетиков, нейролептиков - 0,5-1 мл 2,5% раствора аминазина внутримышечно (при внутривенном введении его может быть коллапс) или 1 мл 0,5% раствора галоперидола внутримышечно.
Введение оксибутирата натрия - натриевой соли гамма-оксимасляной кислоты (ГОМК) - также может оказаться эффективным для купирования болевого приступа. Препарат обладает наркотическим и обезболивающим свойствами, усиливает действие анальгетиков. Оказывает положительное влияние на сердечно-сосудистую систему, повышает устойчивость сердечной мышцы к гипоксии.
Для ограничения размеров некроза и улучшения функции клеток периинфарктной зоны предложено множество методов и медикаментозных средств. Фибринолитическая и антикоагулянтная терапия занимают здесь по-прежнему главенствующее место.
Вопрос о целесообразности использования препаратов, расширяющих коронарные сосуды в острой стадии инфаркта миокарда, остается дискутабельным. Есть указания на то, что, дилатируя в равной степени все артерии сердца, они могут ухудшать кровообращение в зоне закупоренной артерии (синдром "обкрадывания"). Вместе с тем при инфаркте миокарда часто применяют многие антиангинальные препараты [Чазов Е. И. и соавт., 1978].
Имеются сообщения о целесообразности применения β-адреноблокаторов. Однако в связи с отрицательным инотропным действием, которое особенно отчетливо проявляется у пожилых людей, использование их при инфаркте миокарда у гериатрических больных должно проводиться весьма осторожно и дифференцированно. Не следует применять препараты этой группы при кардиогенном шоке, сердечной недостаточности.
В связи с тем что при тахикардии увеличивается потребление сердцем кислорода, замедление ритма может способствовать уменьшению зоны ишемии. Поэтому при тахикардии, связанной с сердечной недостаточностью, показаны сердечные гликозиды.
Для улучшения трофики миокарда, метаболизма используются витамины, особенно группы В, инозин, оротат калия, анаболические стероиды и другие препараты. Считают, что при их назначении, во-первых, представляется возможным ограничить зону инфаркта; во-вторых, улучшить функцию непораженных участков миокарда, что способствует компенсации сниженной сократительной функции сердца и тем самым позволяет предупредить развитие сердечной недостаточности; в-третьих, ускорить процессы рубцевания очага некроза.
С целью защиты ишемизированного миокарда от повреждения применяют глюкозо-калий-инсулииовую смесь, предложенную Sodi-Pollares. При ее введении также повышается внутриклеточное содержание калия в клетках миокарда, что может предупреждать возникновение аритмий. Особенно это важно для пожилых больных, так как даже при физиологическом старении внутриклеточное содержание калия обычно снижено.
В этом аспекте заслуживают также внимания сообщения о целесообразности назначения препаратов, уменьшающих адгезивно-агрегационные свойства тромбоцитов, а также обладающих защитным действием по отношению к эндотелию сосудов [Люсов В. А. с соавт., 1976; Малая Л. Т., Волков В. И., 1979; Грицюк А. И. и соавт., 1979]. Из препаратов этой группы следует указать на ацетилсалициловую кислоту, бутадион, индометацин (метиндол), аминазин, имизин, дипиридамол (курантил, персантин), карбохромен, клофибрат (мисклерон, атромид), пиридинолкарбамат (пармидин, ангинин, продектин) и др. Однако нельзя рассчитывать на значительный терапевтический эффект от их самостоятельного применения при остром инфаркте миокарда, поэтому их используют в комплексной терапии, учитывая возможность их взаимодействия с другими лекарственными препаратами.
Улучшение снабжения кислородом ишемизированного миокарда может быть достигнуто при увеличении напряжения кислорода в артериальной крови (кислородные ингаляции, гипербарическая оксигенация). Однако последний метод не получил широкого распространения в связи со сложностью технических сооружений для проведения гипербарической оксигенации. Отмечено, что пожилые больные лучше переносят оксигенотерапию, когда им кислород дают через носовой катетер или при помощи маски. При назначении кислородных палаток могут возникнуть беспокойство, спутанность сознания, угнетение дыхания. В связи с этим оксигенотерапию у пожилых больных следует проводить при низких концентрациях подачи кислорода и сочетать с препаратами, стимулирующими дыхательный центр.
Необходимо также указать на попытку использования гиалуронидазы как один из путей воздействия на "периинфарктную" зону с целью улучшения микроциркуляции и течения различных биохимических процессов в пограничных с некрозом участках миокарда (Maroko P., Libby P. et al., 1972; Braunwald E., Maroko P., 1976). Предполагается, что после введения гиалуронидазы увеличивается диффузия кислорода в ткани, улучшается микроциркуляция, увеличивается "всасывательная" поверхность клетки. Первые наблюдения показали, что при применении гиалуронидазы происходит значительно более выраженное и быстрое снижение сегмента ST, значительно меньшее увеличение активности креатинфосфокиназы, что позволяет думать об уменьшении зоны ишемии и степени дегенеративных изменений в миокарде.
Применение сердечных гликозидов для поддержания сократительной функции сердца в остром периоде инфаркта миокарда вызывает дискуссию. Однако клинические наблюдения с изучением функционального состояния сердечнососудистой системы, а также показателей внешнего дыхания и газового состава крови дают основание считать показанным больным пожилого и старческого возраста назначение сердечных гликозидов при остром инфаркте миокарда даже без клинических проявлений сердечной недостаточности [Власов К. Ф., Затейщиков В. А., 1962; Коркушко О. В. и соавт., 1965; Чазов Е. И., 1966, 1971; Чеботарев Д. Ф., 1977).
Однако всегда необходимо учитывать более легкое развитие интоксикации и побочные действия гликозидов при их применении у больных инфарктом миокарда пожилого и старческого возраста [Чеботарев Д. Ф., 1968; Кипшидзе Н. Н., Курашвили Р. Б., 1968]. В этой связи рекомендуется применение более мягко действующих гликозидов (строфантин, коргликон, эризимин и др.), уменьшение начальных доз препаратов, вводимых парентерально, тщательный контроль за состоянием больных.
Борьба с тромбообразованием. В настоящее время признается необходимость раннего назначения антикоагулянтов и препаратов тромболитического действия больным инфарктом миокарда при отсутствии у них противопоказаний к такому лечению. Целесообразность назначения антикоагулянтов, в особенности гепарина, определяется также и тем, что они оказывают не только противосвертывающее, но и сосудорасширяющее действие, способствуют устранению болевого синдрома, положительно влияют на проницаемость сосудов, уменьшают вязкость крови, увеличивают скорость кровотока, улучшают периферическое кровообращение, повышают устойчивость к гипоксии. Однако осложнения антикоагулянтной терапии, столь часто наблюдающиеся у пожилых больных, не позволяют проводить ее в полном объеме.
Нарушения функции печени или почек, обычно имеющиеся у пожилых больных, часто приводят к задержке непрямых антикоагулянтов в организме, вследствие чего усиливается их действие. При их назначении следует всегда учитывать возможное взаимодействие с другими лекарствами. Например, действие кумариновых препаратов потенцируют клофибрат (атромидин, мисклерон), этакриновая кислота (урегит), салицилаты, хинидин, метилтиоурацил и др. Некоторые антибиотики (канамицин, неомицин, стрептомицин, тетрациклины) и сульфаниламиды, угнетая синтез витамина К кишечными бактериями, нарушают образование протромбина и тем самым могут привести к передозировке препарата. Все это и определяет необходимость осторожного применения антикоагулянтов у больных инфарктом миокарда пожилого и старческого возраста.
При отсутствии общих противопоказаний рекомендуется под тщательным контролем за основными показателями коагулограммы внутривенное введение 10 000 ЕД гепарина и последующее внутримышечное введение в дозе не менее 5000 ЕД с интервалом, не превышающим 6 ч. Патогенетически обосновано сочетанное применение гепарина с фибринолизином либо другими близкими по механизму действия препаратами (стрептаза, урокиназа и др.). Длительность гепарин-фибринолизирующей терапии определяется индивидуально для больного, в среднем сроки составляют 3-5 сут. в последующем проводится лечение антикоагулянтами непрямого действия. При выборе препарата предпочтение следует отдать фенилину или омефину (группа индандиона), а не кумаринам, так как действие их короче, а осложнения легче купируются.
С целью профилактики повторного инфаркта миокарда антикоагулянты можно рекомендовать и в домашних условиях при соблюдении соответствующего контроля за дозой препарата. Заканчивать лечение нужно постепенным уменьшением суточной дозы на протяжении 10-14 дней с последующим назначением салицилата натрия в дозе 1 г 3 раза в день или реопирина по 1 таблетке 3 раза в сутки в течение 7-10 дней.
Достаточно эффективным применение антикоагулянтов будет только в том случае, если уровень протромбина крови снижается до 40-50% при лечении антикоагулянтами непрямого действия или если общая свертываемость крови снижается в 2-2,5 раза при лечении гепарином. Более низкие уровни представляют опасность, особенно для больных старших возрастов. Это связано с тем, что гериатрические больные чаще имеют повышенную чувствительность к гепарину и к антикоагулянтам непрямого действия. У них нередко значительно снижена активность протромбинового комплекса крови, что делает особенно необходимым учет его исходного уровня. Кроме того, уменьшение количества витамина К в организме нередко является следствием нарушения всасывания его в кишечнике.
К успехам клинической кардиологии несомненно следует отнести разработку и практическое осуществление метода интракоронарного введения фибринолитических препаратов и смесей [Чазов Е. И., Николаева Л. Ф., Руда М. Я.]. При введении фибринолитических препаратов совместно с гепарином непосредственно в область локализации тромба можно при меньших дозах, чем при обычном внутривенном методе введения, добиться более значительного повышения фибринолитической активности крови, ускорить процесс лизиса тромба, уменьшить вероятность нежелательных побочных реакций, так часто наблюдаемых в ответ на введение больших доз фибринолитических средств. При этом область поражения миокарда оказывается меньшей, чем можно было бы ожидать на основании исследований, проведенных до начала лечения фибринолизином, а дальнейшее течение заболевания - благоприятным. По данным Е. И. Чазова, даже в тех случаях, когда не удавалось восстановить кровоток по коронарному сосуду, течение заболевания было более легким, в частности, отмечалась значительно более быстрая положительная динамика сегмента ST, указывающая на улучшение биохимических и электрофизиологических процессов в периинфарктной зоне. Однако эффективность этого вида терапии в гериатрической практике еще не доказана.
В случаях передозировки антикоагулянтов и фибринолитических препаратов и возникновения геморрагического синдрома следует их отменить и назначить антидоты. В тяжелых случаях приходится прибегать к переливанию гемостатических, а при необходимости и заместительных доз крови, введению викасола, желатины. В случаях выраженного повышения фибринолитической активности крови вводят ε-аминокапроновую кислоту.
Профилактика опасных нарушений сердечного ритма является важной проблемой при лечении больных инфарктом миокарда, особенно в пожилом и старческом возрасте, так как позволяет уменьшить смертность при этом заболевании.
Патогенез аритмий при инфаркте миокарда следует рассматривать достаточно широко. Возникновение аритмий связано не только с повреждением миокарда, но и с многими другими факторами - изменениями в гемодинамике, кислотно-щелочном состоянии, электролитном балансе и т. д. Поэтому мероприятия, проводимые по нормализации этих сдвигов, в определенной степени являются и способами профилактики аритмий [Руда М. Я., Зыско А. П., 1977].
Для профилактики аритмий используются также многие антиаритмические препараты. Однако необходимо всегда помнить о возможных их отрицательных влияниях и в первую очередь на сократительную способность миокарда, гемодинамику, функцию проводимости. Наибольшее внимание привлекают лидокаин, новокаинамид, β-адреноблокаторы, кордарон, введение "поляризующих" смесей, которые в значительной степени предупреждают возникновение нарушения ритма.
Особо следует выделить лидокаин. Это один из наиболее активных антиаритмических препаратов, обладающий малой токсичностью, отсутствием выраженного побочного действия и практически не имеющий противопоказаний к применению. Назначение лидокаина в остром периоде инфаркта миокарда позволяет значительно уменьшить возникновение желудочковой тахикардии и "первичной" фибрилляции желудочков, которые, как известно, являются основной причиной всех смертельных исходов.
М. Я. Руда, А. П. Зыско (1977) с целью профилактики рекомендуют вводить внутривенно первоначальную дозу лидокаина 100 мг. В дальнейшем терапевтическая концентрация препарата поддерживается внутривенной капельной инфузией со скоростью 1-3 мг/мин либо внутривенным его введением в дозе 50-100 мг каждые 30-40 мин. Эти мероприятия следует проводить в течение первых 2 сут заболевания.
Лечение нарушений ритма и проводимости в остром периоде инфаркта миокарда необходимо осуществлять в условиях постоянного мониторного наблюдения, обеспечивающего быструю диагностику и точный контроль эффективности терапевтических мероприятий. Для успешного лечения необходимо знание особенностей клинического течения аритмий, их патогенеза, а также механизма действия применяемых антиаритмических препаратов, их фармакокинетики. Особое значение следует придавать оптимальному дозированию, способам введения, оценке переносимости, учитывая, что у больных инфарктом миокарда имеется особая ранимость миокарда. Необходимо всегда учитывать состояние гемодинамики и проводящей системы сердца.
На ранних этапах инфаркта возникновение аритмий связано с электрической нестабильностью миокарда и обусловлено в основном ишемией, тогда как в более поздние сроки их появление зависит от нарушений электролитного баланса, недостаточности кровообращения, лекарственной интоксикации.
Следует помнить, что не все виды аритмии имеют одинаковую клиническую значимость. К примеру, желудочковая тахикардия требует срочного лечения, а редкая желудочковая и предсердная экстрасистолии могут расцениваться как относительно доброкачественные нарушения ритма.
В комплексе терапевтических мероприятий при нарушении ритма у больных инфарктом миокарда важным, если это позволяет ситуация, является нормализация кислотнощелочного состояния, электролитного баланса, улучшение состояния кровообращения, метаболизма миокарда, уменьшение выраженности гипоксии. Отмечено, что при гипокалиемии ослабляется антиаритмический эффект почти всех антиаритмических препаратов.
Синусовая тахикардия у молодых больных редко выступает в качестве причины серьезных нарушений функции сердца. Вместе с тем известно, что частота сердечных сокращений является существенным фактором, определяющим потребность миокарда в кислороде. Поэтому у пожилых людей вследствие возрастных изменений коронарных артерий, особенностей метаболизма миокарда тахикардия нежелательна и требует устранения ее причины. Чаще у больных инфарктом миокарда пожилого возраста синусовая тахикардия является отражением сердечной недостаточности, и поэтому показаны сердечные гликозиды.
При синусовой тахикардии, не связанной с сердечной недостаточностью, можно рекомендовать малые дозы резерпина - по 0,1 мг 2 раза в день, малые дозы (β-адреноблокаторов (по 20 мг анаприлина 2-3 раза в день), верапамил. Особого внимания заслуживает кордарон, который, снижая автоматизм синусового узла, не оказывает отрицательного влияния на сократительную способность миокарда. Используются также и малые дозы сердечных гликозидов в расчете на их ваготропное действие.
Синусовая брадикардия требует лечения в тех случаях, когда из-за низкой частоты сердечных сокращений снижается артериальное давление, прогрессируют признаки сердечной недостаточности, когда на фоне брадикардии проявляется активность эктопических очагов. Основная задача лечения - увеличить частоту сердечных сокращений.
Применяют атропин - 0,5-1 мл 0,1% раствора, который вводят подкожно или внутривенно. С этой целью можно также использовать платифиллин или эуфиллин. При отсутствии эффекта можно применить изопропилнорадреналин, стимулирующий β-адренергические рецепторы (изупрел, изопротеренол, новодрин, алудрин и др.), под контолем ЭКГ. Если медикаментозная терапия не дает желательного эффекта, прибегают к эндокардиальной электростимуляциии предсердий.
Предсердная экстрасистолия мало влияет на гемодинамику, однако ее появление может быть предвестником предсердной тахикардии. Предсердная экстрасистолия, связанная с повышенным давлением в левом желудочке в результате сердечной недостаточности, проходит при улучшении сократительной способности миокарда под влиянием сердечных гликозидов. Эффективными оказываются также хинидин, новокаинамид, верапамил, β-адреноблокаторы, кордарон, этмозин.
Желудочковая экстрасистол и я при остром инфаркте, даже редкая (3-5 экстрасистол в минуту), должна привлекать внимание врача. Особую опасность представляют желудочковые экстрасистолы типа R на T (приближение экстрасистолических импульсов к зубцу T предшествующего комплекса). Такие экстрасистолы принято называть "ранними".
В случае появления экстрасистолий на фоне синусовой брадикардии первым мероприятием будет попытка ускорить ритм. Препаратом выбора при желудочковой экстрасистолии является лидокаин (при предсердных экстрасистолах препарат малоэффективен). В этих случаях начальную дозу (70-150 мг) вводят внутривенно, так как лидокаин быстро инактивируется в организме; в дальнейшем поддерживающая доза составляет 1 мг/кг. Эту дозу вводят через 15- 30 мин внутривенно струйно либо капельно со скоростью 1-4 мг/мин. Задачей врача является подбор минимальной дозы препарата, при введении которой не наблюдается нарушения ритма. Суточная доза 3-4 г.
В последние годы появились сообщения о высокой эффективности мекситила (мексилетин-гидрохлорид) при лечении желудочковой экстрасистолии. По своему механизму действия мекситил близок к лидокаину. Первоначально назначают внутрь ударную дозу 400-600 мг, в дальнейшем через 2 ч - стандартную дозу по 200-250 мг 3 раза в день. Можно использовать также комбинированное введение при необходимости быстрого достижения терапевтической концентрации в организме. Для этого используют внутривенное введение 100-250 мг мекситила в течение 5-10 мин вместе с его приемом внутрь 400 мг и через 2 ч начинают лечение стандартной дозой 200-250 мг 3-4 раза в день.
При продолжающемся внутривенном лечении вслед за первой дозой 100-250 мг в течение первого часа вводят дополнительно 250 мг, а затем в течение последующих 2 ч еще 250 мг препарата. После этого мекситил вводят из расчета 0,5-1 мг/мин до тех пор, пока не появится возможность приема препарата внутрь (назначают стандартную дозу 200-250 мг 3-4 раза в сутки). Следует подчеркнуть, что данных об особенностях применения этого препарата в гериатрической практике нет.
Применяют также новокаинамид, который в отличие от лидокаина оказывает эффект и при предсердных экстрасистолах. Начальная доза 750-1000 мг, поддерживающая - 250-500 мг с интервалом 3-4 ч. С известной осторожностью используют также хинидин. Назначают дифенин (вначале 300-500 мг внутривенно медленно, поддерживающая доза внутрь 200-400 мг/сут), аймалин (вначале внутривенно 50 мг в течение 3-5 мин, поддерживающая доза 200- 400 мг/сут), изоптин (5-10 мг внутривенно, затем внутрь в суточной дозе 240 мг в 3-4 приема),кордарон (100-200 мг, 2-3 раза в день, поддерживающая доза 200-300 мг/сут). Можно также использовать карбамазепин, орнид (тозилат бретилия), этмозин, В-адреноблокаторы и комбинированные препараты.
При экстрасистолии, возникшей в связи с дигиталисной интоксикацией, показана отмена препарата, введение препаратов, содержащих калий (особенно целесообразно назначение поляризующей смеси), применение антиаритмических препаратов - β-адреноблокаторов при отсутствии нарушения атриовентрикулярной проводимости, изоптина, дифенина, лидокаина, мекситила, новокаинамида. Общепринятым мероприятием при дигигалисной интоксикации является применение донаторов SH-группы - унитиола, Na2-ЭДТА.
Пароксизмальная тахикардия и другие тахиаритмии у пожилых больных часто приводят к сердечной недостаточности, ухудшению коронарного кровообращения. Поэтому лечебная тактика всегда определяется тем, насколько неотложна необходимость в нормализации ритма.
При суправентрикулярных тахикардиях в некоторых случаях достаточно эффективными являются мероприятия, направленные на повышение тонуса блуждающего нерва: надавливание на синокаротидную область (проба Чермака), на глазные яблоки (проба Ашнера), а также проба Вальсальвы, вызывание рвоты и др. Однако у пожилых больных этот вид воздействия в большинстве случаев оказывается неэффективным в связи с ослаблением влияния блуждающего нерва на сердце. Более того, при инфаркте миокарда проведение указанных проб нежелательно.
Для купирования суправентрикулярных тахикардий применяют также введение других ваготропных средств (прозерин, пахикарпин). Однако следует указать на их малую эффективность и плохую переносимость в старости.
Иногда пароксизм суправентрикулярной тахикардии можно купировать введением быстродействующих сердечных гликозидов (дигоксин, лантозид, строфантин, коргликон) или введением наркотических анальгетиков, например 1 мл 1% раствора морфина.
Из антиаритмических препаратов используют внутримышечное введение новокаинамида, реже внутривенное введение в связи с возможным резким снижением артериального давления. Применяют также верапамил (изоптин), дифенин, β-адреноблокаторы, орнид (бретилия тозилат), аймалин, кордарон. Следует подчеркнуть, что орнид и кордарон могут применяться при нарушении проводимости.
Если пароксизм предсердной тахикардии не удается купировать назначением антиаритмических средств и он сопровождается резким падением артериального давления, прогрессирующей сердечной недостаточностью, болями в области сердца, прибегают к электроимпульсной терапии. Она противопоказана лишь при пароксизмальной тахикардии, вызванной гликозидной интоксикацией. После электроимпульсной терапии необходима поддерживающая медикаментозная терапия для предупреждения повторных нарушений ритма с соблюдением общих правил антиаритмической терапии.
Желудочковая тахикардия требует всегда принятия срочных мер. Это связано с тем, что у пожилых быстро прогрессирует сердечная недостаточность иногда с развитием аритмогенного шока, часто возникает переход в фибрилляцию желудочков. Если позволяет состояние больного, следует прибегать к внутривенному введению лидокаина, мекситила по схемам, приведенным выше. При отсутствии указанных средств можно также использовать и другие антиаритмические препараты, вводимые внутривенно (новокаинамид, аймалин, изоптин, дифенин, орнид). Можно использовать внутривенное введение β-адреноблокаторов - анаприлина (индерал, обзидан). Однократно вводят не более 5 мг препарата со скоростью 0,25 мг в минуту. Следует помнить, что при таком способе введения может наблюдаться падение артериального давления.
Если медикаментозное лечение не оказывает эффекта либо состояние больного резко ухудшается в связи с прогрессирующей сердечной недостаточностью, показана электроимпульсная терапия. Кардиоверсию проводят дефибриллятором при напряжении разряда электрического тока 4500-5000 В.
Электростимуляцию сердца можно использовать и для лечения тахиаритмий. Она проводится так же, как и при брадиаритмиях. Зонд-электрод по венам проводят в правые отделы сердца и в зависимости от вида нарушения осуществляют электростимуляцию предсерий либо желудочков. При этом частота импульсов устанавливается на 5-10% выше, чем частота сокращений сердца во время пароксизма [Руда М. Я., Зыско А. П., 1977]. Таким образом, сердцу навязывают новый ритм - более частый. После перехода на синусовый ритм частоту электрической стимуляции постепенно уменьшают, доводя до частоты синусового узла, после чего электростимулятор отключают. Этот подход используют при рецидивирующих пароксизмах тахикардии, которые плохо поддаются медикаментозной терапии.
При возникновении фибрилляции желудочков эффективным методом является электрическая дефибрилляция и весь комплекс реанимационных мероприятий. Наши наблюдения, проведенные совместно с Д. Ф. Чеботаревым и соавт. (1969), свидетельствуют об ее эффективности и у больных пожилого и старческого возраста. Среди больных острым инфарктом миокарда в возрасте старше 60 лет положительные результаты реанимации с применением дефибрилляции были получены в 21,7% случаев; двухмесячная выживаемость в этой группе составила 13,4%, тогда как у молодых этот показатель был соответственно 48,9 и 34%.
Лечение нарушений атриовентрикулярной проводимости следует начинать с введения 0,5-1 мл 0,1% раствора атропина или эуфиллина. При полной атриовентрикулярной блокаде используют большие дозы глюкокортикоидов, препараты, выводящие калий (гипотиазид), изопропилнорадреналин (изопротеренол, изупрел). Необходима коррекция кислотно-щелочного состояния крови.
Однако следует подчеркнуть, что применение изопропилнорадреналина может привести к экстрасистолии.
Наиболее действенной терапией при полной атриовентрикулярной блокаде является электрическая стимуляция сердца с помощью биполярного катетера-электрода, вводимого в правый желудочек через подключичную, кубитальную или бедренную вену под рентгенологическим и электрокардиографическим контролем. При отсутствии восстановления проводимости в течение 3 нед прибегают к имплантации постоянного стимулятора.
Наиболее целесообразно применение кардиостимуляторов типа "деманд", работающих по требованию, с учетом электрической активности сердца больного. Это определяется тем, что если момент восстановления проводимости будет пропущен, то возникнут условия, при которых сердце одновременно будет находиться под влиянием двух водителей ритма: естественного синусового и искусственного кардиостимулятора. Все это может привести к развитию тяжелых нарушений ритма вплоть до фибрилляции желудочков.
При синоаурикулярной блокаде показано введение атропина; если она обусловлена сердечными гликозидами, их следует отменить и проводить соответствующую терапию.
Продольные блокады сердца (блокады ножек пучка Гиса) не вызывают сами по себе нарушения кровообращения. Опасность представляет прогрессирующее замедление внутрижелудочковой проводимости, что нередко заканчивается асистолией.
У больных острым инфарктом миокарда при предсердно-желудочковой блокаде показанием к электростимуляции сердца являются: 1) наличие приступов Адамса - Стокса - Морганьи; 2) выраженная и особенно прогрессирующая недостаточность кровообращения; 3) сочетание предсердно-желудочковой блокады с другими нарушениями проводимости и ритма; 4) частота желудочковых сокращений менее 40-45 в минуту [Руда М. Я., Зыско А. П., 1977].
Кроме того, в ряде случаев представляется целесообразным предварительное введение зонда-электрода в правый желудочек с тем, чтобы при необходимости немедленно начать электростимуляцию: 1) при атриовентрикулярной блокаде I-II степени с тенденцией к брадисистолии, 2) при атриовентрикулярной блокаде III и IV степени без видимых нарушений гемодинамики и частоте желудочковых сокращений не менее 45 в минуту, 3) при блокаде правой ножки пучка Гиса и нарушении проводимости (даже перемежающемся) хотя бы одной из ветвей левой.
Как свидетельствуют клинические наблюдения, такая тактика эффективна также в гериатрической практике и значительно улучшает прогноз у таких больных. Так, по данным R. Harris (1970), применение электростимуляции сердца у больных пожилого и старческого возраста с атриовентрикулярной блокадой привело к значительному снижению летальности с 85 до 55%.
Лечение кардиогенного шока определяется его формой. Так, при рефлекторном шоке основным является купирование болевого синдрома и назначение вазотонических средств: кордиамина, коразола, небольших доз мезатона (0,3-0,5 мл 1% раствора). В связи с тем что у пожилых больных в его развитии имеет также значение снижение сократительной способности, вводят внутривенно небольшие дозы быстродействующих сердечных гликозидов (строфантин, коргликон). При синусовой брадикардии показано подкожное введение 0,5-1 мл 0,1% раствора атропина.
При аритмической форме шока (тахиаритмии, брадиаритмии) основной задачей является нормализация ритма. Однако в комплекс лечебных мероприятий обычно включаются и другие методы воздействия, направленные на улучшение гемодинамики, которые будут изложены при рассмотрении истинного кардиогенного шока.
Как уже указывалось, в основе истинного кардиогенного шока лежит резкое ослабление пропульсивной силы сердца. Поэтому основной задачей терапевтических воздействий является повышение сократительной способности миокарда. Однако клинический опыт свидетельствует, что в такой ситуации применение сердечных гликозидов часто оказывается малоэффективным. С целью повышения сократительной способности миокарда используют прессорные амины - норадреналин, мезатон, которые стимулируют как β-, так и α-адренергические рецепторы. Важным является то, что небольшие дозы оказывают преимущественно инотропное действие, тогда как при больших дозах проявляется выраженный вазоконстрикторный эффект.
Норадреналин вводят внутривенно капельно 0,025-0,1 мкг/мин на 1 кг массы больного. В этой дозе он оказывает преимущественно положительный инотропный эффект за счет стимуляции в основном β-адренергических рецепторов. Обычно для этого 1 мл 0,2% раствора норадреналина растворяют в 250-300 мл 5% глюкозы или изотонического раствора хлорида натрия. Быстрота введения препарата регулируется в зависимости от реакции артериального давления и ритма сердца. При достижении систолического уровня АД 100-110 мм рт. ст. скорость введения норадреналина уменьшают. В этих условиях обычно обеспечивается достаточный коронарный кровоток и кровообращение во внутренних органах.
Мезатон является менее эффективным препаратом и вводится внутривенно по тем же правилам, что и норадреналин. Мезатон можно вводить и медленно внутривенно шприцем в дозе 0,5-1 мл 1% раствора в 20 мл изотонического раствора хлорида натрия или 5% раствора глюкозы под контролем артериального давления. В отличие от норадреналина, который вызывает некроз при внутримышечном введении, мезатон в дозе 0,3-0,5 мл 1% раствора можно вводить внутримышечно.
Вместе с тем следует подчеркнуть, что вопрос о целесообразности применения прессорных аминов и их дозах при кардиогенном шоке до настоящего времени остается в центре внимания дальнейших исследований. Известно, что при кардиогенном шоке, особенно тяжелом, наблюдается выраженная вазоконстрикция артериол, повышение периферического сосудистого сопротивления. Поэтому введение больших доз прессорных аминов, особенно пожилым и старым больным, может усугубить нарушения микроциркуляции, резко увеличить нагрузку на сердце. Кроме того, и это важно для гериатрической практики, доказано, что с возрастом повышается чувствительность сердечно-сосудистой системы к различным медиаторам, в том числе прессорным аминам. Поэтому рекомендуется медленное введение малых доз препаратов из этой группы пожилым и старым больным.
С целью уменьшения вазоконстрикторного влияния на периферические сосуды и тем самым улучшения микроциркуляции прессорные амины назначают совместно с блокаторами адренергических α-рецепторов (феноксибензамин, фентоламин). Этой способностью обладают также аминазин (хлорпромазин) и некоторые другие препараты фенотиазинового ряда. Однако следует помнить, что в случаях пониженного сосудистого тонуса прием α-адреноблокаторов может усилить гипотонию и тем самым ухудшить коронарный кровоток.
Из других препаратов, применяемых для уменьшения вазоконстрикции, следует указать на папаверин, ношпу, дроперидол.
Определенный эффект в комплексной терапии кардио- генного шока достигается при назначении β-адреностимуляторов (изадрин, изопротеренол, изупрел и др.). В связи с β-адренергическим эффектом препараты этой группы оказывают положительное инотропное воздействие на миокард, снижают вазоконстрикцию емкостных и резистивных сосудов. Однако следует сказать о неблагоприятном влиянии этих препаратов на метаболизм миокарда и возможность возникновения аритмий. Эти изменения чаще наблюдаются у пожилых больных.
Весьма обнадеживающие результаты при лечении больных кардиогенным шоком получены при применении глюкагона. Препарат обладает выраженным положительным инотропным действием на миокард, по своему механизму отличающимся от действия сердечных гликозидов. При одномоментном внутривенном введении его эффект проявляется почти сразу. Максимум действия наступает через 10 мин с постепенным уменьшением на протяжении последующих 30 мин. Из побочных явлений следует указать на тошноту, рвоту, которые, однако, быстро исчезают при уменьшении дозы препарата.
Есть основания считать, что у пожилых и старых больных доза глюкагона должна быть уменьшена, так как при старении, если судить по его гипергликемическому эффекту, повышается чувствительность к указанному препарату [Коркушко О. В., Орлов П. А., 1972]. Этот положительный инотропный эффект связан с активацией аденилциклазной системы миокардиальных волокон, посредством которого он, как и катехоламины, осуществляет положительное ино- и хронотропное влияние на сердце. В отличие от катехоламинов глюкагон действует через так называемые глюкагоновые рецепторы. К тому же глюкагон не вызывает резкого повышения артериального давления, не обладает аритмогенным действием и может применяться в сочетании с β-адреноблокаторами, сердечными гликозидами и даже в случаях гликозидной интоксикации. Глюкагон вводится одномоментно внутривенно в дозе 4-6 мг либо внутривенно капельно со скоростью 4-16 мг/ч.
При лечении кардиогенного шока используют глюкокортикоиды (преднизолон, гидрокортизон и др.) в больших дозах. В литературе имеются данные о том, что преднизолон больным молодого возраста нередко назначают внутривенно до 1000-2000 мг/сут. Пожилым больным в связи с повышением чувствительности суточная доза глюкокортикоидов должна быть уменьшена до 100-200 мг. Под их влиянием повышается минутный объем крови, улучшается микроциркуляция. При этом также отмечено, что эффективность изопропилнорадреналина (изопротеренол, изупрел) повышается после назначения больших доз кортикостероидов.
Как уже указывалось, в дифференцированном лечении истинного кардиогенного шока существенным является изучение возникающих гемодинамических особенностей. Поэтому целесообразно определять давление в легочной артерии, давление заполнения левого желудочка, что особенно важно для выработки показаний к восполнению массы циркулирующей крови и контролю за его коррекцией. Артериальное давление следует определять "кровавым" методом, ибо при шоке его изучение методом Короткова может дать существенную ошибку.
При гиповолемии показано внутривенное введение плазмозаменителей (плазмоэкспандеры) - реополиглюкина, реомакродекса, декстрана и др. При их введении улучшается также микроциркуляция. Вводят плазмоэкспандеры со скоростью 30-50 мл/мин под контролем давления наполнения в левом желудочке или конечно-диастолического давления в легочной артерии. Менее информативным показателем является центральное венозное давление. Если симптомы левожелудочковой недостаточности усугубляются или центральное венозное давление повышается до 140-150 мм вод. ст. и выше, введение плазмоэкспандеров следует прекратить. При отсутствии указанных плазмозаменителей допустимо использование изотонического раствора натрия хлорида, 5% раствора глюкозы.
При повышенном притоке крови к сердцу, о чем можно судить по высокому уровню центрального венозного давления, в последнее время стали использовать активные вазодилататоры - нитропруссид натрия, нитроглицерин, а также гидралазин, обладающий α-адреностимулирующим действием.
При кардиогенном шоке в терапию необходимо всегда включать коррекцию кислотно-щелочного состояния и электролитного баланса. Это связано с тем, что возникающий у таких больных метаболический ацидоз может являться причиной ослабления прессорной реакции на катехоламины, снижения сократительной способности миокарда, сердечного выброса и предрасполагать к развитию аритмий. К тому же длительно существующий метаболический ацидоз может вызвать значительные, а иногда и необратимые изменения в различных органах и тканях. Как показывают исследования, учет этих факторов приобретает особое значение у гериатрических больных, так как указанные нарушения развиваются не только быстрее, но и имеют более выраженный характер.
При лечении отека легких основные усилия должны быть направлены на: 1) усиление сократительной способности левого желудочка; 2) уменьшение венозного притока крови к сердцу с целью разгрузки малого круга кровообращения; 3) улучшение условий оксигенации; 4) воздействие на центральную нервную систему и снижение активности симпатико-адреналовой системы; 5) дегидратацию легких.
Одновременно с этим необходимы устранение болевого синдрома, снижение артериального давления при его повышении, коррекция кислотно-щелочного состояния, электролитного баланса, антиаритмическая терапия при нарушении ритма.
С целью усиления сократительной способности миокарда чаще всего используют внутривенное введение быстродействующих гликозидов (строфантин, коргликон) лучше всего вместе с поляризующей смесью. Для повышения сократительной способности миокарда наряду с сердечными гликозидами можно вводить и глюкагон. Следует помнить, что при инфаркте миокарда, особенно у пожилых больных, переносимость сердечных глюкозидов уменьшается.
Наряду с этим внутримышечно или внутривенно вводят 1 мл 1% раствора морфина или 1 мл 2% раствора промедола. Особенно эффективным является введение фентанила в сочетании с дроперидолом (таламонал).
Уменьшению венозного притока крови к сердцу способствуют сидячее положение, наложение жгутов на конечности, ножные горячие ванны. Жгуты накладывают на бедра как можно выше.
Весьма эффективны ганглиоблокаторы. Предпочтение среди препаратов этой группы следует отдать арфонаду (50 мг препарата растворяют в 250 мл физиологического раствора хлорида натрия и вводят внутривенно под постоянным контролем артериального давления). Однако его способность вызывать резкое падение артериального давления (рядом нужно иметь капельницу с ангиотензином) резко ограничивает сферу его применения.
Уменьшение венозного притока, массы циркулирующей крови, дегидратация легких достигается внутривенным введением быстродействующих мочегонных средств - фуросемида (лазикса), этакриновой кислоты, осмотических диуретиков (маннит, мочевина, ПЭГ-400).
В последние годы при острой левожелудочковой сердечной недостаточности с целью уменьшения венозного возврата, уменьшения нагрузки на сердце начали использовать так называемые периферические вазодилататоры (нитропруссид натрия, нитроглицерин, гидралазин). Клинический опыт их применения, однако, невелик. Отмечается хороший эффект нитроглицерина при сердечной астме и отеке легких [Чазов Е. И., Руда М. Я., 1979]. Вместе с тем подчеркивается, что применение периферических вазодилататоров может сопровождаться резким снижением артериального давления вследствие неадекватности дозы и недостаточного контроля за центральной гемодинамикой. В гериатрии этот новый важный подход в лечении сердечной недостаточности практически не исследован. Как показывает клинический опыт применения нитроглицерина у старых людей, назначать его необходимо с осторожностью, так как в обычных дозах он часто резко снижает артериальное давление даже у лиц с сохранной сократительной функцией миокарда.
Венозное кровопускание производят, если нет другой возможности быстро и эффективно уменьшить венозный приток крови к сердцу. При отеке легких у больных инфарктом миокарда используют также глюкокортикоиды (гидрокортизон, преднизолон), механизм действия которых в этой ситуации неясен.
Эуфиллин помогает ликвидировать бронхоспазм, так часто возникающий у пожилых больных при отеке легких. Кроме того, он снижает давление в легочной артерии. Противопоказанием к его внутривенному введению является гипотония. При отеке легких показано также применение антигистаминных препаратов (димедрол, супрастин, пипольфен и др.).
С целью улучшения оксигенации крови проводят ингаляции кислорода. Наилучшим методом является ингаляция кислорода через катетеры, вставленные в носовые ходы. Предварительно всегда проводят аспирацию пены из верхних дыхательных путей и трахеи при помощи механического или электрического отсоса. Для уменьшения пенообразования в дыхательных путях применяют ингаляцию поверхностно-активных веществ, так называемых пеногасителей. С этой целью используют ингаляцию паров 70-80% раствора этилового спирта, который заливают вместо воды в увлажнитель кислородного аппарата. Антифомсилан в виде 10% спиртового раствора вводят с помощью аэрозольного распылителя. Длительность ингаляции 15 мин (2-3 мл антифомсилана), производят ее 2-3 раза с интервалами 10-15 мин.
Если перечисленные методы лечения не помогают и отек легких нарастает, используют искусственную вентиляцию легких при повышенном давлении. Это способствует вытеснению отечной жидкости из альвеол обратно в кровеносное русло и уменьшает приток крови к правым отделам сердца и к легким. Обычно через несколько минут при такой искусственной вентиляции легких исчезают хрипы в легких, значительно уменьшается цианоз. Однако это еще не означает, что отек легких полностью купирован, и поэтому терапию необходимо продолжать.
После ликвидации отека легких в дальнейшем больному длительно назначают сердечные гликозиды, мочегонные препараты с соблюдением соответствующих предосторожностей, рассматриваемых в главе о сердечной недостаточности.
Для профилактики тромбоэмболий назначают антикоагулянты, с целью предупреждения пневмонии, которая особенно часто развивается у больных пожилого возраста в связи с возрастными изменениями аппарата внешнего дыхания, оправдано назначение антибиотиков.
Последовательность проведения основных лечебных мероприятий при отеке легких может быть представлена в следующем виде.
1. Придание больному полусидячего или сидячего положения в кровати.
2. Аспирация пены из верхних дыхательных путей.
3. Ингаляция кислорода с пеногасящими препаратами. Эффективно вдыхание кислорода под повышенным давлением.
4. Внутривенное введение морфина.
5. Внутривенное введение быстродействующих диуретиков - фуросемида (лазикс), этакриновой кислоты. Применяют также и осмотические диуретики (маннит, мочевина, ПЭГ-400).
6. Введение быстродействующих сердечных гликозидов. Если перед этим больной не получал препаратов дигиталиса, то следует сразу же ввести внутривенно строфантин, коргликон.
7. Назначение препаратов, улучшающих кровообращение в малом круге (феноксибензамин, эуфиллин и др.).
8. Назначение периферических вазодилататоров (нитропруссид натрия, нитроглицерин, гидралазин) под контролем артериального давления.
Симптоматическое лечение может оказаться необходимым у больных инфарктом миокарда, особенно в старческом возрасте, когда имеется множество сопутствующих болезней, а каждое повреждение влечет за собой дополнительные расстройства.
Больным спсихомоторным возбуждением в остром периоде инфаркта миокарда назначают диазепам, нейролептики - дроперидол, галоперидол, а при выраженной тревоге, подавленности применяют транквилизаторы. В последующих периодах при необходимости проводят терапию психотропными средствами всех групп (нейролептики, транквилизаторы, антидепрессанты) в сочетании с рациональной психотерапией.
При парезе желудочно-кишечного тракта с целью активации его моторной функции назначают церукал, прозерин, внутривенное введение гипертонического 10% раствора натрия хлорида. В тяжелых случаях прибегают к паранефральной блокаде. Выраженное расширение желудка при его парезе со значительным накоплением желудочного содержимого и рвота могут привести к обезвоживанию организма, изменению электролитного и кислотно-щелочного состояния, поэтому в комплексной терапии необходимо предусмотреть коррекцию этих нарушений.
Обязательным является отсасывание желудочного содержимого с последующим промыванием 2% раствором натрия гидрокарбоната. Рекомендуется голод и лишь по мере ликвидации пареза диету постепенно расширяют. Питание должно быть щадящим, малыми порциями.
Важное значение в лечении больных пожилого возраста имеет борьба с инфекцией. Хотя вначале температура может быть связана с инфарктом миокарда, все же ее повышение на 3-4-й день чаще свидетельствует о наличии воспалительного процесса прежде всего в легких или мочевыводящей системе и поэтому является показанием к назначению антибиотиков.
Реабилитация. Больной острым инфарктом миокарда в течение первых дней должен находиться в палате интенсивного наблюдения и терапии под постоянным наблюдением специально обученного персонала. Кардиальные мониторы этих палат дают возможность следить за частотой и ритмом пульса, частотой дыхания, наблюдать в динамике за изменениями ЭКГ как в состоянии полного покоя больного, так и при небольших функциональных нагрузках.
Относительно строгости постельного режима в острый и подострый периоды инфаркта, особенно в гериатрической практике, все еще нет единого мнения.
Покой оказывает благотворное влияние на сердечнососудистую систему пожилых больных, однако назначать строгий постельный режим более чем на 2 нед не рекомендуется, так как при более продолжительной обездвиженности у пожилых значительно быстрее, чем у людей среднего возраста, возникает ряд изменений в функциональных системах организма. Постельный режим у них особенно отрицательно воздействует на функции компенсаторных механизмов, способствует развитию застойной пневмонии, тромбофлебита или флеботромбоза, которые являются наиболее частой причиной эмболии легочной артерии. При длительном постельном режиме отмечается склонность к развитию пролежней, нарушению мочеиспускания, особенно при аденоме предстательной железы и воспалительных процессах мочевых путей. Легко возникают атрофические изменения в мышцах, прогрессируют возрастные артрозы. При гипокинезии нарушается равновесие биохимических констант - продуцирование катехоламинов, альдостерона, изменяется баланс электролитов. Сердечно-сосудистая система становится особенно чувствительной к адренергическим воздействиям, легко возникает ортостатическая гипотония.
В связи с этим некоторые исследователи рекомендуют назначать программу весьма активного поведения вплоть до пользования стульчаком при дефекации уже в первые дни неосложненного инфаркта, а также более раннего вставания и ходьбы. Однако этот подход не достаточно обоснован.
Д. Ф. Чеботарев (1977), основываясь на многолетнем клиническом наблюдении, считает наиболее целесообразным рекомендовать в гериатрической практике средние сроки активации (табл. 3), предложенные Институтом кардиологии АМН СССР (1972). Следует подчеркнуть, что приведенные сроки ориентировочны и зависят от общего состояния больного, обширности поражения миокарда, наличия осложнений.
Таблица 3. Сроки активации больных инфарктом миокарда (по данным Института кардиологии АМН СССР, 1972)
В первые дни острого периода инфаркта миокарда больной, безусловно, должен соблюдать строгий постельный режим. По указанию врача сестра может повернуть больного на бок. Мочеиспускание и акт дефекации производятся в постели. Надо разъяснить больному опасность активного изменения положения, недопустимость пользования туалетом.
Важная роль принадлежит медицинскому персоналу, который должен обеспечить больному психический покой. В каждом отдельном случае решается вопрос о посещениях, передаче писем и телеграмм, о возможности приема тех продуктов питания, которые приносят больному.
В первые дни острого периода инфаркта миокарда, особенно при наличии болей в области сердца, питание больного лучше ограничивать. Большинству больных назначают диету с ограничением соли (1 г соли). Такая диета снижает опасность задержки хлорида натрия в организме и развития сердечной недостаточности. В последующие дни назначают протертый творог, паровые котлеты, овощи и фрукты в виде пюре при резко сниженной калорийности и ограничении жидкости (600-800 мл). Не следует давать сладостей и блюд, вызывающих вздутие живота, которое отрицательно влияет на функцию сердца. Питание должно быть дробным. Увеличивают калорийность по мере улучшения состояния больного постепенно за счет продуктов, содержащих полноценные белки (мясо, рыба в отварном виде) и углеводы (каши, черный хлеб, сырые протертые фрукты и др.).
Весьма важно следить за функцией кишечника, так как запоры, вздутие кишечника ухудшают течение болезни. Вместе с тем отсутствие опорожнения кишечника в первые несколько дней острого периода не должно вызывать беспокойства. Больного следует предупредить, чтобы он не напрягался при акте дефекации. В то же время не следует допускать каловых завалов, так как они могут быть причиной болей в животе, затрудненного мочеиспускания, кишечной непроходимости. Необходимо всегда учитывать то обстоятельство, что назначение клизм у таких больных может вызвать падение артериального давления или другие побочные явления. Поэтому основной упор следует делать на пероральное назначение слабительных, а также рекомендовать прием фруктов, обладающих послабляющим действием, таких, как сливы, яблоки и др. Адекватный прием жидкости также способствует регулярному опорожнению кишечника.
При благоприятном течении инфаркта миокарда к концу второй недели наступает-период клинической стабилизации с относительным восстановлением кровообращения. Исчезают признаки выраженной сердечной и сосудистой (резкой гипотонии) недостаточности, уменьшается или исчезает стенокардия, прекращаются тахикардия и аритмия, нормализуется температура, наблюдается положительная динамика на ЭКГ. Вместе с тем следует всегда помнить, что замещение некротизированного участка сердца соединительной тканью - рубцевание - при благоприятном течении заболевания у пожилых и старых людей в связи со снижением репаративных процессов несколько задерживается и составляет обычно 5-7 нед [Harris R., 1970].
Раннее (с учетом состояния больного) применение лечебной физкультуры, небольших дозированных физических нагрузок, легкий массаж груди, живота, конечностей являются важными моментами в терапии пожилых больных, в профилактике осложнений. На первом этапе предусматриваются сначала в положении лежа дыхательные упражнения, пассивные движения конечностей, которые выполняют сестра и методист физкультуры, а затем активные упражнения для конечностей без значительной нагрузки. При этом все движения должны сочетаться с правильным глубоким дыханием. В этот же период и даже на первой неделе заболевания рекомендуется проводить легкий массаж всего тела, конечностей. При переходе больного в положение сидя (вначале пассивное, с помощью сестры) необходимо тщательно контролировать пульс, дыхание. Уже этот небольшой объем двигательной активности обычно благоприятно действует на физическое состояние больного и на его настроение.
На 3-4-й неделе лечебная физкультура проводится уже в положении сидя с постепенным переходом к дозированной ходьбе по комнате и по коридору, с дыхательными упражнениями в вертикальном положении. Массаж конечностей следует продолжать.
Выписка из стационара (при благоприятном течении болезни на 5-8-й неделе) должна основываться на физических возможностях больного. Учитывают динамику всех исследований; должна быть проверена реакция сердечно-сосудистой системы на обычные для повседневной жизни движения и нагрузки, связанные с самообслуживанием. Дальнейшая реабилитация осуществляется в условиях санатория и поликлиники.
Родственники больного должны быть проинструктированы о рациональном режиме больного, его питании, медикаментозных средствах, применяемых, в частности, во время приступов болей в области сердца и одышки.
После выписки из стационара возникает целый ряд психологических проблем, связанных с режимом, который может осуществлять больной: может ли он возвратиться к прежней работе, возобновить сексуальную активность и другие вопросы.
Все эти вопросы должны решаться реабилитационной службой поликлиники на основании результатов наблюдения за больным, перенесшим инфаркт миокарда, в течение пол угода или даже года.
Следует помнить, что старые люди любят жизнь так же, как и молодые. Успокоение и ободрение Являются существенным мероприятием, чтобы предотвратить развитие кардиофобии. Этот подход важен потому, что у мнительных, встревоженных больных нередко развивается порочный круг: боли в груди и мысль о них, мысль о них и боли в груди [Master А., 1961]. Больных следует успокоить в отношении их прогноза и посоветовать вести нормальный образ жизни, избегая чрезмерных напряжений, переедания и стрессовых ситуаций.
Больной ишемической болезнью сердца должен знать, что стенокардия обусловлена повышением потребности его сердца в кислороде, поэтому при возникновении болей он нуждается в покое и приеме нитроглицерина.
Следует рекомендовать прогулки с учетом общего состояния, физические упражнения, работу в саду, другие обычные виды деятельности. Больному не следует запрещать подниматься по лестнице, если эта нагрузка не вызывает приступа болей, одышки, ухудшения самочувствия. Больным ИБС следует избегать изотонических нагрузок, таких, как, например, поднятие тяжестей, так как в этих условиях значительно повышается артериальное давление.
Надо поощрять посильный физический труд и соответствующее возрасту участие в общественной жизни. Обычно нет необходимости планировать возвращение пожилого больного к труду ради заработка, но в тех случаях, когда материальное положение больного требует этого, такая возможность не исключается. Однако им не следует находиться на работе, связанной с экстренными действиями, возможным возникновением длительного стресса и неблагоприятными условиями внешней среды [Harris R., 1970].
Курение при ИБС следует запретить. Борьба с избыточной массой тела имеет существенное значение в лечении таких больных. Отмечено, что снижение избыточной массы тела оказывает благоприятное влияние на течение заболевания. Однако это осуществить у пожилых больных очень трудно, так как у них обменные процессы снижены и к тому же вследствие возрастных изменений опорно-двигательного аппарата физически они менее активны.
Суровый холодный климат, переохлаждения оказывают отрицательное влияние на течение заболевания. Рекомендуется носить теплую одежду (шерстяное нижнее белье, шерстяные носки, свитер, пальто и др.), избегать переохлаждения.
При отсутствии противопоказаний санаторно-курортное лечение является эффективным средством воздействия для больных ишемической болезнью сердца. Для пожилых и старых больных следует рекомендовать лечение в санаториях местного типа.
Профилактика ишемической болезни сердца - это устранение факторов, предрасполагающих к заболеванию, в частности атеросклероза, устранение либо уменьшение стрессорных ситуаций, выяснение которых так необходимо для пожилых больных. Это связано с тем, что в этом возрастном периоде диапазон адаптационно-приспособительных механизмов крайне ограничен, и их воздействие может привести к повторному инфаркту, снизить эффективность реабилитационных мероприятий.
Очень важно, с нашей точки зрения, применение так называемых гериатрических средств, которые благодаря своему биологическому эффекту повышают неспецифическую сопротивляемость стареющего организма, повышают его устойчивость ко всякого рода стрессорным воздействиям. К ним относятся: поливитаминные комплексы, анаболические стероиды, новокаин и др. При этом все они в различной мере являются и антисклеротическими препаратами.
Вторичная профилактика направлена непосредственно на патологический процесс, на синдром болезни и предупреждение ее осложнений, на борьбу с развитием и прогрессированием атеросклероза и обострением коронарной недостаточности. С этой целью в гериатрической практике широко применяют антисклеротические, коронарорасширяющие средства, препараты, улучшающие обменно-трофические процессы в сердечной мышце. Считаем целесообразным для долговременной профилактики коронаротромбоза прием непрямых антикоагулянтов и стимуляторов фибринолиза, однако необходимо всегда учитывать более высокую чувствительность и низкую толерантность организма пожилого и старого человека к фармакологическим агентам.
|
ПОИСК:
|
© GELIB.RU, 2013-2019
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'
При использовании материалов проекта обязательна установка активной ссылки:
http://gelib.ru/ 'Геронтология и гериатрия'